新疆盐碱地面积分布广、种类多,是最大的农业可开发后备土地资源[1],但由于盐碱地土壤结构差不利于农作物生长,其中微生物种类数量也因不同盐碱地种类而有所差异,所以在盐碱土壤改良过程中,盐碱土土壤结构及微生物多样性成为了很多研究者的关注重点。棉粕在新疆的产出量随棉花产量增加而增加[2],由于其存在的毒害物质限制了其利用[3-5],但作为一种新的盐碱土改良剂,其养分种类多,可以为盐碱土壤提供有机物质和作物需要的相应营养物质,改善土壤结构,从而改善土壤中微生物的生存环境。
微生物是土壤中不可缺少的部分,种类繁多、数量庞大,在特定或环境恶劣的土壤中存在特定的微生物[6]。土壤盐碱化使得微生物生境发生改变,生存活动受到胁迫,从而使得该土壤环境下的微生物种类、数量、生理功能及遗传特性不同于其他正常类型土壤中的微生物状况。微生物通过分泌的代谢物或菌根菌丝对土壤直接进行团聚作用或者物理缠绕从而影响土壤团聚结构的形成和稳定,进而,土壤团聚结构的动态变化又间接表明了土壤微生物活动状况,而且微生物是有机质胶结土壤团聚体的重要催化剂和原动力[7]。这些微生物的代谢活动决定了土壤物理性状及结构的稳定性[8]。所以进一步研究分析棉粕改良盐碱土土壤中微生物的分布及多样性的研究,有利于更好地利用盐碱土,调节微生物活性及数量,从而更有效地把盐碱土逐步地转变为可利用土壤。
随着现代科技技术的突飞猛进,微生物多样性检测技术越来越多样化、精准化、方便化,本文利用棉粕探究盐碱土中微生物群落结构的多样性,采用现今最为普遍的新一代高通量测序技术[9-11]来分析盐碱土壤条件下微生物多样性,以此充分了解该研究区域内盐碱土壤内微生物群落结构多样性以及优势种,便于今后的盐碱土壤微生物的研究。
1 材料与方法 1.1 研究区概况2016年试验于石河子大学农学院试验站内进行(86°08′ 20.72′′E,44°18′ 42.37′′N),海拔高度450.8 m,年平均气温6.5 ~ 7.2 ℃,全年日照时数2 721 ~ 2 818 h,无霜期147 ~ 191 d,年降雨量125.0 ~ 207.7 mm,年蒸发量1 000 ~ 1 500 mm,属温带大陆性气候。试验土壤类型为灌溉灰漠土,质地重壤。所使用改良材料棉粕的常规养分含量[12]为:干物质900 g/kg、粗纤维105 g/kg、无氮浸出物289 g/kg、粗灰分6.0 g/kg,磷、有效磷、钾、镁分别为10.4、2.06、11.6、4.0 g/kg。
1.2 试验设计供试作物为棉花,在试验的前一年用NaCl和Na2CO3盐对试验区土壤预先进行盐化处理,共设置7个处理(表 1),棉花播种前一个月将棉粕均匀撒施于土壤中并进行翻埋,提前腐熟。试验小区面积5 m2,小区间距1.5 m,每个处理重复3次,共21个小区。试验采用滴灌模式,一膜两管四行,配置模式40+20+40,膜距40 cm,行距20 cm。氮、磷、钾肥按照20︰9︰18于播种前作基肥一次性施入。4月30日播种,10月2日收获。
|
|
表 1 试验设置 |
于棉花收获期分别采集0 ~ 20 cm耕层原状土样,每个小区采3点混合,分成两份,一份置于自封袋中并置于冰盒中,及时带回实验室置于零下80 ℃超低温冰箱中用于微生物多样性检测;一份置于塑料盒中,带回室内自然风干,用于土壤结构组成及扫描电镜测定。在取土和运输过程中尽量减少对土样不必要的搬动,以免破坏土壤团聚体。室内沿自然纹路掰成小土块,除去新生体和动植物残体后自然风干[13],然后采用干筛法分离出5 ~ 2 mm、2 ~ 0.25 mm、< 0.25 mm共3级团聚体。
1.4 测定指标及方法土壤微生物多样性:基于Illumina HiSeq测序平台,利用双末端测序(Paired-End)的方法,构建小片段文库进行测序。通过对Reads拼接过滤,OTUs(operational taxonomic units)聚类,并进行物种注释及丰度分析。
土壤机械结构组成及形态观察:干筛法[14],扫描电镜[15]。
2 结果与分析 2.1 棉粕对不同盐碱土壤结构的影响根据团聚体形成胶结剂的种类,可将团聚体分为大团聚体(> 250 μm)和微团聚体(< 250 μm)[16]。而在土壤团聚体形成的过程中,不同粒级的团聚体形成因素也有所不同,如很多微小团聚体由植物根系分泌物或土壤微生物活动及代谢产物的胶结逐步形成较大团聚体,其次,微团聚体则主要通过有机物质的胶结形成,而大团聚体主要通过菌根网络和植物根系的缠绕作用形成[17]。
由表 2可知随着氯化钠浓度的提高,盐处理下小粒径(< 0.25 mm)土壤比例呈上升趋势。且由图 1土壤SEM图像(1 000倍)可以看出,添加棉粕的处理相比CK,土壤疏松多孔、表面粘附有较多粘结物质,进而形成相应土壤结构,其可能是由植物根系及微生物分泌物的作用下形成微小的土壤结构,这些微小结构又由有机质胶结为微团聚体。但在碱处理下,随着碳酸钠浓度的提高,小粒径土壤比例呈下降趋势,大粒径(2.00 ~ 5.00 mm)土壤比例呈上升趋势,表明在植物根系或菌丝的作用下,土壤结构向大团聚体方向转变,再加上碳酸钠性质上的影响,土壤会板结,致使微生物的作用远远弱于碳酸钠对土壤的影响,由电镜扫描图像也可看出这种趋势。由表 3可知随着盐碱浓度的提高,总体上土壤pH、EC值也随之提高,但是氯化钠处理的pH低于碳酸钠处理,EC值高于碳酸钠处理,体现出氯化钠与碳酸钠处理下土壤性质有着明显的不同,这也导致两种处理下土壤结构出现了不同的性状。而这盐碱处理下土壤结构的转变都是将土壤结构向不利于作物生长的土壤环境方向进行,即使在棉粕这种有机物质及微生物活动和分泌物的胶结作用下可使土壤结构发生改变,但是其胶结作用弱于氯化钠对于土壤的分散作用及碳酸钠对土壤的凝结,对于MN、MA处理的土壤结构在棉粕的作用下相比于LN、LA和HN、HA处理呈现较好土壤结构状态。
|
|
表 2 0 ~ 20 cm土层各粒级所占百分比(%) |

|
(A、B、C、D、E、F、G分别表示CK、LN、MN、HN、LA、MA、HA处理) 图 1 土壤扫描电镜图像(1 000倍) |
|
|
表 3 土壤pH、EC值 |
土壤环境决定了土壤中微生物的生存环境及可利用的资源,土壤环境及结构越利于作物的生长就越有利于微生物的生长代谢[18],所以微生物的种类及数量也可以反映一个区域内土壤环境的好坏及开发利用方向。
2.2.1 土壤微生物多样性分析OTU即分类操作单元,是在系统发生学研究或群体遗传学研究中,为了便于进行分析,人为给某一个分类单元(品系、种、属、分组等)设置的同一标志。根据不同的相似度水平,对所有序列进行OTU划分,一般情况下,如果序列之间的相似性高于97%就可以把它定义为一个OTU,每个OTU对应于一种代表序列。由表 4可知,7个处理总的分类单元数为2 234个,均高于单个处理下的OTU数,说明在每个处理下都有不同于其他处理的OTU分类单元,其中可以看出添加棉粕下的盐碱处理相对于CK可使OTU数提高8 ~ 14个,使其微生物多样性有所增加,说明添加棉粕可以使得盐碱环境下的土壤环境向有利于微生物生存活动的方向转变,但在高浓度的盐碱处理下相对于中等浓度盐碱处理的OTU数少2 ~ 6个。
|
|
表 4 多样性指数统计表 |
结合Alpha多样性分析并通过物种累积曲线、多样性曲线和统计学分析指数中的均值、离散程度、最大值、最小值、异常值来评估单样本内微生物群落的丰富度和多样性差异。表 4所示,Chaol和ACE指数可以看出,HN处理和MA处理Chaol和ACE指数相对较高,说明群落丰度较高,CK处理的群落丰富度较低,总体上体现在添加棉粕后都可使盐碱处理的群落丰富度有所增加。从Simpson和Shannon指数可以看出,试验组的群落多样性变化规律不明显,无法结合两种指数对群落多样性进行准确分析,但是,总体上可以看出在MN、MA处理下物种的多样性较高。
2.2.2 土壤细菌群落组成如图 2所示,选定相对丰度高于0.1%的细菌类群制作多样品物种分布图,从图中可以看出,不同处理样品中在门水平上主要包括酸杆菌门(Acidobacteria)、放线菌门(Actinobacteria)、拟杆菌门(Bacteroidetes)、绿弯菌门(Chloroflexi)、芽单胞菌门(Gemmatimonadetes)、硝化螺旋菌门(Nitrospirae)、浮霉菌门(Planctomycetes)、变形菌门(Proteobacteria)、疣微菌门(Verrucomicrobia)、厚壁菌门和其他一些未能分类鉴定的微生物类群。不同试验组中优势类群主要为变形菌门、酸杆菌门、芽单胞菌门和放线菌门。由表 5中可看出放线菌门在CK中比其他处理都高,最高可高出3%,说明盐碱处理下不利于放线菌门的生长繁殖,但是对于变形菌门和芽单胞菌门其所占比例普遍高于CK,MN和MA处理下变形菌门相对于CK处理所增幅度可达3%和2%,其中在氯化钠处理下放线菌、芽单胞菌、变形菌所占比例高于碳酸钠处理下,酸杆菌则相反。
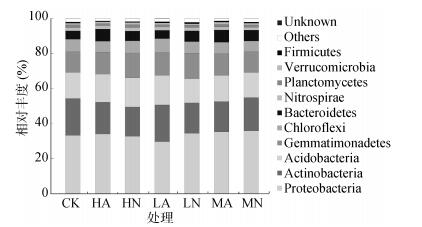
|
图 2 不同处理门水平上细菌群落组成 |
|
|
表 5 不同处理土壤微生物优势类群(%) |
如图 3所示,基于OTU结果用不同颜色变化来表示不同样品在科水平上的群落组成相似性,图中所表示的是不同处理下科水平热图聚类情况。从图中可以看出,HA处理和LA处理的相似性较近,聚为一类,CK、MN、HN及LN可聚为一类。MA处理位于较远的聚类分支上,且MA处理与其他组在颜色分布上相差较大,从而可以看出盐处理下和碱处理下的微生物聚集情况不相似。
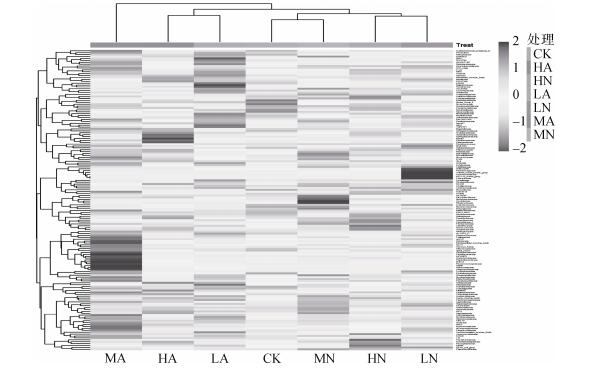
|
图 3 各水平物种丰度聚类热图 |
土壤盐碱化影响微生物种类、数量及活动代谢状况,反之微生物活动代谢又可以利于土壤结构的改善,利于植被的生长[19]。土壤团聚的形成与有机质及微生物紧密联系着,微生物并且也是其形成过程中最为活跃的生物因素[20],通过外源向土壤添加有机质也可以改变土壤团聚体组成,王双磊等[2研究发现用棉花秸秆还田可使小团聚体向大团聚体转变,使小团聚体含量减少大团聚体增加,该趋势与碳酸钠处理中土壤团聚体变化一致,氯化钠处理则表现出小团聚体相对空白处理来说有明显的增加,其原因可能是氯化钠本身施入土壤后对土壤表现出较强的分散作用,以至于棉粕对氯化钠处理下土壤团聚作用弱于其分散作用。王清奎等[22]认为土壤团聚体的形成过程中,微生物除了分泌多糖类胶结物质使微团聚体进行粘结,还会通过菌丝进行物理缠绕将大团聚体进行粘结,但是微生物持续性的分解土壤有机质会对已经形成的土壤结构造成破坏[23],本研究中棉粕作为有机质施入盐碱土壤中,为其增加了胶结物质也为微生物提供了生存物质,使得处理下的土壤结构在微生物及有机质的协助下得到相应优化,相反也为微生物营造了适合其生存的土壤结构,表现出不同的微生物多样性。
土壤微生物数量及种类都非常之庞大,不同环境中的微生物表现出的功能也不尽相同,自然环境相比人类影响下具有特有的微生物群落[24],其环境中的优势种也有所差异。郑贺云等[25]以新疆阿克苏地区52个盐碱土样为研究对象发现,新疆盐碱地中细菌群落结构丰富,并发现了21个优势菌属,包括假单胞菌属、芽孢杆菌属、盐单胞菌属等,表明盐碱土中微生物群落结构与环境因子是紧密相关的。牛世全等[8]研究发现河西走廊盐碱土中变形菌门为原生盐碱土和农田土中的优势菌门,放线菌门是次生盐碱土中的优势菌门且分布的细菌多嗜盐碱细菌,而原生盐碱土中的微生物多样性最低,但优势菌属较次生盐碱土和农田土多。Canfora等[26]以意大利西西里岛不同盐浓度的盐碱土作为微生物多样性研究对象,发现占优势的菌门包括变形菌门、放线菌门、酸杆菌门、疣微菌门和厚壁菌门,其中变形菌门种群所占比例最大高达95.5%,其次就是放线菌门占83.39%。李新等[27]以不同盐碱程度盐碱土作为研究对象发现,土壤盐碱化程度越低,土壤细菌群落多样性及丰富度越高,其中变形菌(α-变形菌纲、β-变形菌纲、γ-变形菌纲和δ-变形菌纲)是盐碱土壤的主要类群。这一系列研究发现的占优势菌与本文研究发现结果一致,这说明在盐碱这种特定的盐碱化土壤条件下微生物类群分布具有相似性,且放线菌门与变形菌门是盐碱土中最为普遍的两种[28-29]。
4 结论1) 在棉粕这种有机物质及微生物活动的胶结作用下可使土壤结构发生改变,使其氯化钠处理下随盐分的增加小团聚由于植物与微生物分泌物及有机质的作用所占比例呈上升趋势,而碳酸钠处理则相反,但是其胶结作用弱于氯化钠对于土壤的分散作用及碳酸钠对土壤的凝结作用,对于中度盐碱处理下的土壤结构在棉粕的作用下相比于低盐碱和高浓度盐碱呈现最好土壤结构状态。
2) 通过土壤生物信息学分析可知,向盐碱土中添加棉粕改良剂可以增加土壤中微生物种群数量,盐碱条件下土壤中占优势的菌门有酸杆菌门、放线菌门、芽单胞菌门、变形菌门,其中变形菌门种群所占比例最大达36%,氯化钠处理下放线菌、芽单胞菌、变形菌所占比例高于碳酸钠处理下,酸杆菌则相反。
| [1] |
关胜超.松嫩平原盐碱地改良利用研究[D].哈尔滨: 中国科学院大学, 2017. http://cdmd.cnki.com.cn/Article/CDMD-80062-1017930182.htm
(  0) 0) |
| [2] |
王安平, 吕云峰, 张军民, 等. 我国棉粕和棉籽蛋白营养成分和棉酚含量调研[J]. 华北农学报, 2010, 25(S1): 301-304 DOI:10.7668/hbnxb.2010.S1.068 (  0) 0) |
| [3] |
聂蓬勃.发酵法降低棉粕中游离棉酚含量及提高其营养价值的研究[D].武汉: 华中农业大学, 2008. http://cdmd.cnki.com.cn/Article/CDMD-10504-2008203658.htm
(  0) 0) |
| [4] |
刘昌峨.棉籽蛋白粉营养价值的研究[D].重庆: 西南大学, 2006. http://cdmd.cnki.com.cn/Article/CDMD-10635-2006150448.htm
(  0) 0) |
| [5] |
秦金胜, 禚梅, 许衡, 等. 发酵棉粕和普通棉粕替代豆粕对猪生长性能的影响[J]. 新疆农业大学学报, 2010, 33(6): 496-501 DOI:10.3969/j.issn.1007-8614.2010.06.007 (  0) 0) |
| [6] |
林先贵, 胡君利. 土壤微生物多样性的科学内涵及其生态服务功能[J]. 土壤学报, 2008, 45(5): 892-900 DOI:10.3321/j.issn:0564-3929.2008.05.016 (  0) 0) |
| [7] |
李娜, 韩晓增, 尤孟阳, 等. 土壤团聚体与微生物相互作用研究[J]. 生态环境学报, 2013, 22(9): 1625-1632 DOI:10.3969/j.issn.1674-5906.2013.09.027 (  0) 0) |
| [8] |
牛世全, 龙洋, 李海云, 等. 应用Illumina MiSeq高通量测序技术分析河西走廊地区盐碱土壤微生物多样性[J]. 微生物学通报, 2017, 44(9): 2067-2078 (  0) 0) |
| [9] |
秦楠, 栗东芳, 杨瑞馥. 高通量测序技术及其在微生物学研究中的应用[J]. 微生物学报, 2011, 51(4): 445-457 (  0) 0) |
| [10] |
倪培相.新一代高通量测序技术在微生物基因组学研究中的应用[C].中国微生物学会第三届全国微生物基因组学学术研讨会, 2012.
(  0) 0) |
| [11] |
Han Y, Xu L, Liu L, et al. Illumina sequencing reveals a rhizosphere bacterial community associated with foxtail millet smut disease suppression[J]. Plant&Soil, 2016, 410: 1-11 (  0) 0) |
| [12] |
熊本海, 罗清尧, 赵峰, 等. 中国饲料成分及营养价值表(2015年第26版)制订说明[J]. 中国饲料, 2015(21): 23-33 (  0) 0) |
| [13] |
郑子成, 何淑勤, 王永东, 等. 不同土地利用方式下土壤团聚体中养分的分布特征[J]. 水土保持学报, 2010, 24(3): 170-174 (  0) 0) |
| [14] |
江春玉, 刘萍, 刘明, 等. 不同肥力红壤水稻土根际团聚体组成和碳氮分布动态[J]. 土壤学报, 2017, 54(1): 138-149 (  0) 0) |
| [15] |
谢萍若, 左敬兰. 变用扫描电镜对几种土壤特征层的微形态观察[J]. 土壤学报, 1980, 17(2): 182-186, 204-206 (  0) 0) |
| [16] |
Tisdall J M, Oades J M. Organic matter and water-stable aggregates in soils[J]. Journal of Soil Science, 1982, 33(2): 141-163 (  0) 0) |
| [17] |
Elliott E T. Aggregate structure and carbon, nitrogen, and phosphorus in native and cultivated soils[J]. Soil Science Society of America Journal, 1986, 50(3): 627-633 DOI:10.2136/sssaj1986.03615995005000030017x (  0) 0) |
| [18] |
夏北成. 植被对土壤微生物群落结构的影响[J]. 应用生态学报, 1998, 9(3): 296-300 DOI:10.3321/j.issn:1001-9332.1998.03.016 (  0) 0) |
| [19] |
徐阳春, 沈其荣, 冉炜. 长期免耕与施用有机肥对土壤微生物生物量碳、氮、磷的影响[J]. 土壤学报, 2002, 39(1): 89-96 DOI:10.3321/j.issn:0564-3929.2002.01.013 (  0) 0) |
| [20] |
程丽娟, 来航线, 李素俭, 等. 微生物对土壤团聚体形成的影响[J]. 西北农业大学学报, 1994, 22(4): 93-97 DOI:10.3321/j.issn:1671-9387.1994.04.012 (  0) 0) |
| [21] |
王双磊, 刘艳慧, 宋宪亮, 等. 棉花秸秆还田对土壤团聚体有机碳及氮磷钾含量的影响[J]. 应用生态学报, 2016, 27(12): 3944-3952 (  0) 0) |
| [22] |
王清奎, 汪思龙. 土壤团聚体形成与稳定机制及影响因素[J]. 土壤通报, 2005, 36(3): 415-421 DOI:10.3321/j.issn:0564-3945.2005.03.031 (  0) 0) |
| [23] |
Lynch J M, Bragg E. Microorganisms and soil aggregate stability[M].
Springer, New York, 1985: 133-171
(  0) 0) |
| [24] |
Zahran H H. Diversity, adaptation and activity of the bacterial flora in saline environments[J]. Biology&Fertility of Soils, 1997, 25(3): 211-223 (  0) 0) |
| [25] |
郑贺云, 黎志坤, 李超, 等. 新疆阿克苏地区盐碱地细菌类群多样性及优势菌群分析[J]. 微生物学通报, 2012, 39(7): 1031-1043 (  0) 0) |
| [26] |
Staff T P O. Correction:Salinity and bacterial diversity:To what extent does the concentration of salt affect the bacterial community in a saline soil[J]. Plos One, 2014, 9(9): e114658-e114658 (  0) 0) |
| [27] |
李新.不同盐碱程度盐碱土壤微生物多样性研究[D].呼和浩特: 内蒙古师范大学, 2015. http://cdmd.cnki.com.cn/Article/CDMD-10135-1015431976.htm
(  0) 0) |
| [28] |
Ma B, Gong J. A meta-analysis of the publicly available bacterial and archaeal sequence diversity in saline soils[J]. World Journal of Microbiology&Biotechnology, 2013, 29(12): 2325-2334 (  0) 0) |
| [29] |
Valenzuela-Encinas C, Neria-González I, AlcántaraHernández R J, et al. Changes in the bacterial populations of the highly alkaline saline soil of the former lake Texcoco (Mexico) following flooding[J]. Extremophiles, 2009, 13(4): 609-621 DOI:10.1007/s00792-009-0244-4 (  0) 0) |
 2020, Vol. 52
2020, Vol. 52


