2. 中国科学院烟台海岸带研究所,海岸带环境过程与生态修复重点实验室,山东烟台 264003;
3. 中国科学院海洋大科学研究中心,山东青岛 266071;
4. 中国科学院土壤环境与污染修复重点实验室南京土壤研究所,南京 210008
深入认识重金属离子在植物根际微界面的过程与机制有助于揭示植物适应重金属胁迫的生理机制,同时也可为控制重金属向食物链迁移提供科学依据。受技术手段限制,对植物吸收富集重金属离子的研究通常是以植物的整个器官或组织作为研究对象并通过化学方法分析其含量[1-3]。这些传统分析方法操作相对简单、易行,但同时也存在其局限性,主要表现在两方面:其一,对样本的破坏性,不能反映活体植物吸收金属离子的特性; 其二,分析的时空分辨率低,其反映的是一定时间内整个器官或组织对某种离子吸收浓度的平均值,无法实时测定根系微区离子的动态吸收过程。后来出现的同位素示踪、荧光显微成像技术和膜片钳技术等,虽然也在一定程度上可以对活体植物的离子分布和运动规律进行检测,但是这些方法普遍具有时间分辨率差的缺点。
非损伤微测技术(Non-invasive Micro-test Technology,NMT)是一种实时、动态测定活体材料的新技术,它通过测定进出材料的离子或分子的流速反映生命活动的规律,是生理功能研究的最佳工具之一[4-5]。1990年,美国科学家Kühtreiber和Jaffe[6]首次提出扫描微电极技术(非损伤微测技术起源)并成功测量出了Ca2+进出细胞的流速,从而开创了由生物活体静态测量到动态测量转变的先河。非损伤微测技术具有独特的分析时间(0.5 s)和空间(2 ~ 5 μm)分辨率,它的测定过程在根的表面完成而不需要侵入植物体,从而很好地避免了对样本的破坏性而带来的研究误差甚至假象。因此,利用这个技术能够对植物吸收、释放及转运离子或者分子的根际过程和机制形成更深入的理解和统一认识。
目前可以搭载在非损伤微测系统上使用的微电极有玻璃电极、碳丝电极和金属电极等类型; 可以检测的离子或分子主要有Ca2+、H+、K+、Na+、Mg2+、NH4+、Cl-、NO- 3、Cd2+、Cu2+、Pb2+及O2、H2O2、CO2、NO等[7-17]; 被测样品不仅仅局限于植物,也可以应用于细胞、动物等生命样品和金属材料、颗粒材料和膜材料等非生命样品。NMT目前已广泛应用于植物生长发育和逆境胁迫等研究领域,受重金属微传感器种类的限制,其在重金属毒理效应与机制研究中的应用亟待进一步拓展和深入。Zn作为一种植物生长的必需微量元素,在植物的生长发育过程中发挥着至关重要的作用[18],但当其在植物体内的累积量达到一定值时也会表现出毒性效应[19]。随着Zn肥在农业中的广泛应用、Pb/Zn矿的开发以及工业废水的排放和大气沉降过程等影响,导致Zn在土壤中大量积累[20]。利用非损伤微测技术可以对Zn2+在植物根际微界面的动态过程进行实时、活体检测,这将有助于我们深入认识植物适应Zn毒害的生理机制。然而,由于传统Zn2+选择性宏观电极所使用的离子载体普遍存在灵敏性低、对其他离子抗干扰性差、响应时间长等问题,无法用于非损伤微测系统的微传感器中。为实现活体植物根表Zn2+离子流的实时、动态检测,需开发、表征、优化一种新型Zn2+选择性微电极来满足非损伤微测系统对离子流检测的要求。
伴矿景天(Sedum plumbizincicola)作为我国发现的Zn/Cd超积累植物[21-26],因其对Zn和Cd超富集能力已被成功应用于治理修复Zn/Cd污染土壤[27]。本研究以伴矿景天幼苗作为受试生物材料,通过研发的新型非损伤微测Zn2+选择性微电极成功实现了植物根际Zn2+离子流的实时、动态、活体检测,同时与其根际不同微区的Cd2+离子流特征进行了对比研究。
1 材料与方法 1.1 试剂、仪器与材料本研究所用试剂硝酸铜[Cu(NO3)2]、硝酸铅[Pb(NO3)2]、硝酸钙[Ca(NO3)2]、硝酸镁[Mg(NO3)2]、硝酸钠(NaNO3)、硝酸镉[Cd(NO3)2]、硝酸钾(KNO3)、硝酸铵(NH4NO3)、氯化钾(KCl)、乙二胺四乙酸二钠(Na2EDTA)均为分析纯试剂,购于国药集团化学试剂有限公司; 锌离子载体Ⅰ(tetra-n-butyl thiuram disul-fide,TBTDS)、锌离子载体Ⅳ(Potassium hydrotris(N- tert-butyl-2-thioimidazolyl)borate,[TmBut]K)、邻苯二甲酸二丁酯(Dibutyl phthalate, DBP)、硝基苯辛基醚(2-Nitrophenyl octyl ether, o-NPOE)、四(3, 5-二(三氟甲基)苯基)硼酸钠(Sodium tetrakis[3, 5-bis(trifluoro-methyl)phenyl]borate, NaBARF)均购于西格玛奥德里奇(上海)贸易有限公司。
本研究有关微电极的表征与应用测试在非损伤微测系统(YG-MS-001,美国杨格公司)上完成。所用玻璃毛细电极管(XY-CGQ-01)、液体离子交换剂(liquid ions exchanger,LIX)载体管(XY-LIX-01)和Cd2+ LIX均购于旭月(北京)科技有限公司。
1.2 试验方法 1.2.1 Zn2+选择性微电极的制备Zn2+选择性微电极主要包括玻璃毛细电极管、液体离子交换剂LIX和膜后灌充液3部分。LIX主要包括离子载体、亲脂性盐和溶剂3部分。LIX和膜后灌充液的制备参考文献[28-35],并进一步优化改进。首先用接细管的注射器将膜后灌充液从玻璃毛细电极管尾部缓慢推入内部,产生一段液柱(长度约10 mm)直至电极尖端有液体渗出。在显微镜下观察电极内部是否有气泡产生,若产生气泡,须将电极尖端垂直向下放置一段时间,直至气泡完全消失,将玻璃毛细电极管置于显微镜下备用。然后用LIX载体管蘸取少量LIX,制作成LIX池,从尾部给予一定压力使其液面凸出。最后将其放入显微镜下与玻璃毛细电极管置于一个平面,使玻璃毛细电极管尖端接触到LIX凸液面,LIX会逐渐吸入玻璃毛细电极管尖端。当LIX在玻璃毛细电极管中的长度达到100 ~ 120 μm时将其取下,插在固定器的Ag/AgCl丝上并与非损伤微测系统连接备用。
1.2.2 Zn2+选择性微电极的能斯特斜率测试首先配制不同Zn2+浓度的标定液,在非损伤微测系统完成不同标定液电位E的测定。电位E与标定液Zn2+浓度C之间的关系可以用能斯特方程[36]来描述。
| $ E=k \pm s \log C $ | (1) |
式中:E为微电极与参比电极之间的电压,mV; C为标定溶液中Zn2+浓度,mol/L; s为能斯特斜率,mV/decade; k为能斯特截距,mV。其中能斯特斜率s理论值的计算公式为:
| $ s=\frac{2.303 R T}{n F} $ | (2) |
式中:R为气体常数,8.314 J/(K·mol); T为绝对温度,K; F为法拉第常数,9.6487×104 C/mol; n为被测离子的化合价,对于Zn2+,n = 2。在25 ℃时,Zn2+的能斯特斜率s理论值为29.5 mV/decade。
1.2.3 Zn2+选择性微电极的线性响应范围离子选择性微电极在一定检测范围内电位和浓度的对数呈线性关系。对不同Zn2+浓度的标定液使用同一根微电极分别进行3次测量取平均值,得到不同Zn2+浓度的对数与微电极电位之间的关系,即微电极的校正曲线,从而求得Zn2+选择性微电极的线性范围。
1.2.4 Zn2+选择性微电极的响应时间测试Zn2+选择性微电极应用于非损伤微测系统时,响应时间是一个重要的参数。根据IUPAC(International Union of Pure and Applied Chemistry,国际纯粹与应用化学联合会)的推荐,离子选择性微电极的响应时间是指从微电极和参比电极接触标定液时算起(或由标定液中被测物质的浓度发生改变时算起),到电位稳定值的95%所经历的时间(t95%)[37]。本研究使用不同的Zn2+选择性微电极分别对10-3、10-4 mol/L的Zn2+标定液进行多次t95%的测定,寻求响应时间最短的微电极。
1.2.5 Zn2+选择性微电极的选择性系数本研究通过分别溶液法[38]计算选择性系数。将微电极浸入只含有Zn2+溶液中,测得其电位值EZn,然后再将其浸入与主离子浓度相等的只含干扰离子的溶液中,测出其电位值EJ。然后使用以下公式进行计算:
| $ \log K_{\mathrm{Zn}, \mathrm{J}}^{\mathrm{pot}}=\frac{2 F\left\{E_{\mathrm{J}}-E_{\mathrm{Zn}}\right\}}{2.303 R T}+\log \left(\frac{\partial_{\mathrm{Zn}}}{\partial_{\mathrm{J}}^{2 / Z_{\mathrm{J}}}}\right) $ | (3) |
式中:ZJ代表干扰离子所带电荷数; ∂Zn、∂J分别代表Zn2+和干扰离子的活度,mol/L; F代表法拉第常数; R代表理想气体常数。
1.2.6 Zn2+选择性微电极的稳定性测试良好的稳定性是Zn2+选择性微电极应用于非损伤微测系统的必要条件。将Zn2+选择性微电极分别浸入不同浓度的Zn2+标定液中,测定一段时间内的电位值和电位差,电位值和电位差的变化情况可以反映出Zn2+选择性微电极的稳定性。
1.3 供试植物及其生长条件伴矿景天是我国本土发现的一种Zn/Cd超积累植物,幼苗由中国科学院南京土壤研究所提供。在实验室以无性繁殖的方式(扦插)种植,培养在Hogland[39]营养液中,组成为:1.0 mmol/L Ca(NO3)2,1.0 mmol/L K(NO3),0.4 mmol/L MgSO4,0.2 mmol/L KH2PO4,10 μmol/L Fe(Ⅱ)-EDTA,9 μmol/L H3BO4,0.2 μmol/L ZnSO4,0.1 μmol/L CuSO4,2 μmol/L MnSO4,0.02 μmol/L (NH4)6Mo7O24。营养液pH每天用0.1 mol/L HCl或者0.1 mol/L NaOH调节至6.0左右,植物在人工气候室下培养(光周期为白天16 h,黑夜8 h; 白天温度25 ℃,黑夜温度18 ℃; 湿度为75%),保持全天候通气,每两天换一次营养液。
1.4 离子流的检测受试植物伴矿景天幼苗的根用去离子水洗净并固定在培养皿中,加入测试液(组成为0.05 mmol/L Zn(NO3)2,0.1 mmol/L Ca(NO3)2,0.1 mmol/L KNO3、0.1 mmol/L Mg(NO3)2和1 mmol/L NaNO3),平衡10 min至Zn2+流速稳定。将制备好的Zn2+选择性微电极与非损伤微测系统连接,在标准溶液标定完成后分别检测伴矿景天根尖部位(0 ~ 1 000 μm)Zn2+离子流。另外,Cd2+选择性微电极制备和离子流检测流程与Zn2+相似。
离子通量的计算由Fick第一扩散定律求得。通过测定根际表面到X方向30 μm两点之间的电位差ΔV,从而求得ΔC,离子通量由以下计算公式求得:
| $ J=-D \times \frac{\Delta C}{\Delta x} $ | (4) |
式中:J为X方向的离子通量,10-12 mol/(cm2·s); D为离子分子的扩散系数,cm2/s;
本研究首先通过筛选不同的Zn2+载体,排除不能直接溶解于溶剂(o-NPOE和DBP)中的离子载体; 其次,通过调整离子载体(TBTDS、[TmBut]K)与其他组分配比配制LIX,对其进行能斯特斜率表征。当TBTDS、NaBARF和o-NPOE质量比为1:1:8时,微电极能斯特斜率最接近理论值(表 1),故选用此种组分配比作为Zn2+选择性微电极的LIX。进一步通过调整微电极其他的组分来进一步优化微电极的性能。
|
|
表 1 不同组分配比的LIX对微电极斜率的影响 Table 1 Effects of different ratios of LIX on slopes of microelectrodes |
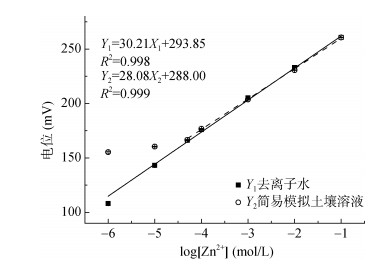
在离子流测试过程中需要保持植物根的正常生理状态,需要在测试液中加入营养离子。本研究同时配制了简易模拟土壤溶液(0.1 mmol/L Ca(NO3)2,0.1 mmol/L KNO3,0.1 mmol/L Mg(NO3)2和1 mmol/L NaNO3)来评价微电极的性能。将做好的Zn2+微电极与非损伤微测系统连接,分别浸入Zn2+浓度为10-6、10-5、5×10-5、10-4、10-3、10-2和10-1 mol/L的去离子水和简易模拟土壤溶液中,测得输出电位。由图 1可知,微电极在去离子水中的线性响应范围为10-6 ~ 10-1 mol/L,其能斯特斜率为30.2 mV/decade; 在简易模拟土壤溶液中,由于共存阳离子的干扰,在低于50 μmol/L的Zn2+浓度时其电位发生偏移,但在5×10-5 ~ 10-1 mol/L范围内仍然呈线性响应,能斯特斜率为28.1 mV/decade。可以看出此微电极在含有不同Zn2+浓度的去离子水和简易模拟土壤溶液中均具有接近于理论值的能斯特响应斜率,这也为后续Zn2+离子流检测结果的准确性和可信度提供了保障。微电极在含有营养离子的简易模拟土壤溶液中也具有较好的能斯特斜率,表明此电极对共存离子表现出较好的抗干扰性。
|
图 1 Zn2+微电极在去离子水和模拟土壤溶液中的校正曲线 Fig. 1 Calibration curves of Zn2+ microelectrode in deionized water and simulated soil solution |
本研究所用的离子载体TBTDS为一种中性载体,在离子选择性电极的研究中普遍证实,中性载体膜往往只对阳离子具有渗透性。因此,它的电化学性能几乎不受亲水阴离子(如Cl-、NO- 3)的影响[40-43]。本研究探究微电极对共存阳离子的选择性,采用公式(3)对微电极的选择性系数进行计算。分别配制浓度为10-2、10-3、10-4 mol/L的Ca(NO3)2、KNO3、Mg(NO3)2、NaNO3、Cu(NO3)2、NH4NO3、Pb(NO3)2、Cd(NO3)2,使用同一根微电极分别测定电位,计算出微电极的选择性系数。由表 2可见,微电极对大部分阳离子表现出较好的选择性,计算所得的
|
|
表 2 微电极的选择性系数以及与其他研究的对比 Table 2 Selectivity coefficients of microelectrodes in this and others studies |
配制10-3 mol/L的Zn(NO3)2溶液,调节pH范围为2.5 ~ 7.5,分别测试电位。由图 2可得,pH在3.5 ~ 7.0范围内电位稳定,微电极在此pH范围内可以正常工作。当pH低于3.5时,微电极受H+的干扰,电位会有所上升; 当pH达到7.0后,由于Zn2+的水解(

|
图 2 pH对Zn2+微电极电位的影响 Fig. 2 Effect of pH on the potential of Zn2+ microelectrode |
研究发现膜后灌充液对微电极的响应时间有很大的影响。由表 3可知,膜后灌充液组成为10 mmol/L Zn(NO3)2和0.1 mmol/L KCl时微电极有最短的响应时间。最终选用组成为10 mmol/L Zn(NO3)2和0.1 mmol/L KCl溶液作为膜后灌充液,响应时间t95%≤ 1 s。微电极较短的响应时间可以节约测试时间,也可以保证离子流测试结果的真实可靠性。
|
|
表 3 不同灌充液对微电极响应时间的影响 Table 3 Effects of different inner liquids on response time of microelectrode |
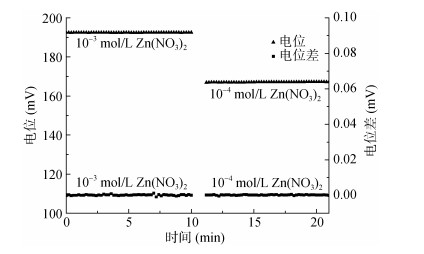
在使用NMT测试样品过程中,信号的稳定性至关重要,所以必须保证微电极本身有稳定的电位值。通过非损伤微测系统测定了电极在10-3、10-4 mol/L Zn(NO3)2标定液中一段时间内的电位值和电极移动一段距离(30 μm)所产生的电位差。如图 3所示,微电极在10 min内电位值几乎不发生改变,电位差也接近于0。这表明微电极有非常好的稳定性,在检测过程中可以避免电位波动所带来的误差。
|
图 3 Zn2+微电极的稳定性测试 Fig. 3 Stability test of Zn2+ microelectrode |
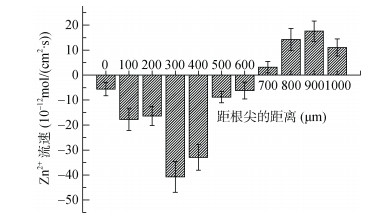
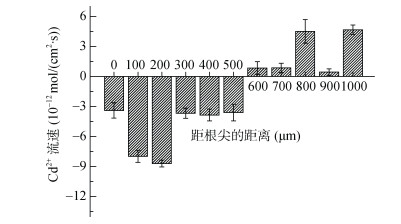
在对Zn2+微电极进行优化和表征后,搭载非损伤微测系统对伴矿景天幼苗进行了根际不同微区Zn2+离子流进行了测定,离子通量由公式(4)计算得出。如图 4所示,伴矿景天在距离根尖600 μm内Zn2+净通量为内吸,且在300 μm处有最强的吸收速率,在700 ~ 1 000 μm处则有明显的Zn2+外排信号。同时,通过Cd2+微电极测得的根际Cd2+离子流数值尽管较Zn2+低,但其在不同微区的轮廓与Zn2+离子流具有类似的规律,表现在距离根尖端0 ~ 500 μm处吸收,在600 ~ 1 000 μm处则表现为外排(图 5)。
|
图 4 伴矿景天根际Zn2+离子流测试 Fig. 4 Zn2+ flux across rhizosphere of Sedum plumbizincicola |
|
图 5 伴矿景天根际Cd2+离子流测试 Fig. 5 Cd2+ flux across rhizosphere of Sedum plumbizincicola |
伴矿景天作为一种Cd/Zn超积累植物,其对高浓度的重金属表现出一定的抗性和耐受性。通过非损伤微测技术发现其在根尖微区存在外排Zn2+、Cd2+的部位,这可能是其避免高浓度重金属对其根部造成损害的一种主动防御措施。作为一种解毒重金属的重要手段,植物可以通过根部主动排出金属离子来降低细胞中不需要的金属浓度,这种依赖于ATP的外排机制首先在白玉草(Silene vulgaris)的根中发现[44],后来也在其他植物的根中发现[45]。但是这种植物主动外排金属离子的分子生物学过程机制目前尚不完全清楚,值得深入分析和研究。
3 结论本研究建立了一种性能优异的非损伤微测Zn2+选择性微电极,并首次实现了对植物根际微区Zn2+离子流的实时、活体检测。这种基于非损伤微测的Zn2+离子流检测技术为活体条件下深入认识Zn2+在植物根-液以及根-茎等微界面的动态传输过程与机制提供了一种强有力的研究手段。
| [1] |
Sun R L, Zhou Q X, Jin C X. Cadmium accumulation in relation to organic acids in leaves of Solanum nigrum L. as a newly found cadmium hyperaccumulator[J]. Plant and Soil, 2006, 285(1/2): 125-134 (  0) 0) |
| [2] |
Yang X E, Li T Q, Long X X, et al. Dynamics of zinc uptake and accumulation in the hyperaccumulating and non-hyperaccumulating ecotypes of sedum alfredii Hance[J]. Plant and Soil, 2006, 284(1/2): 109-119 (  0) 0) |
| [3] |
Lu L L, Tian S K, Yang X E, et al. Improved cadmium uptake and accumulation in the hyperaccumulator Sedum alfredii: The impact of citric acid and tartaric acid[J]. Journal of Zhejiang University Science B, 2013, 14(2): 106-114 DOI:10.1631/jzus.B1200211 (  0) 0) |
| [4] |
贾代东, 刘爱琴, 李惠通, 等. 非损伤微测技术在植物生理生态学研究中的应用进展[J]. 应用与环境生物学报, 2017, 23(1): 175-182 (  0) 0) |
| [5] |
季丹丹, 魏树和, 王嗣淇. 非损伤微测技术及其在环境科学领域的应用[J]. 生态学杂志, 2015, 34(10): 2951-2955 (  0) 0) |
| [6] |
Kühtreiber W M, Jaffe L F. Detection of extracellular calcium gradients with a calcium-specific vibrating electrode[J]. The Journal of Cell Biology, 1990, 110(5): 1565-1573 DOI:10.1083/jcb.110.5.1565 (  0) 0) |
| [7] |
Ma Y, Dai X Y, Xu Y, et al. COLD1 confers chilling tolerance in rice[J]. Cell, 2015, 160(6): 1209-1221 DOI:10.1016/j.cell.2015.01.046 (  0) 0) |
| [8] |
Miao R, Wang M, Yuan W, et al. Comparative analysis of Arabidopsis ecotypes reveals a role for brassinosteroids in root hydrotropism[J]. Plant Physiology, 2018, 176(4): 2720-2736 DOI:10.1104/pp.17.01563 (  0) 0) |
| [9] |
Chen T X, Wang W L, Xu K, et al. K+ and Na+ transport contribute to K+/Na+ homeostasis in Pyropia haitanensis under hypersaline stress[J/OL]. Algal Research, 2019, 40[2020-02-28]. https://doi.org/10.1016/j.algal.2019.101526.
(  0) 0) |
| [10] |
李俊周, 李梦琪, 刘磊, 等. 水稻种子H2O2流速和种子活力的关系研究[J]. 华北农学报, 2017, 32(4): 189-194 (  0) 0) |
| [11] |
Liu Y, Yu Y C, Sun J Y, et al. Root-zone-specific sensitivity of K+-and Ca2+-permeable channels to H2O2 determines ion homeostasis in salinized diploid and hexaploid Ipomoea trifida[J]. Journal of Experimental Botany, 2019, 70(4): 1389-1405 DOI:10.1093/jxb/ery461 (  0) 0) |
| [12] |
Sa G, Yao J, Deng C, et al. Amelioration of nitrate uptake under salt stress by ectomycorrhiza with and without a Hartig net[J]. New Phytologist, 2019, 222(4): 1951-1964 DOI:10.1111/nph.15740 (  0) 0) |
| [13] |
Sun J, Chen S L, Dai S X, et al. NaCl-Induced alternations of cellular and tissue ion fluxes in roots of salt-resistant and salt-sensitive poplar species[J]. Plant Physiology, 2009, 149(2): 1141-1153 DOI:10.1104/pp.108.129494 (  0) 0) |
| [14] |
Anwar A, Li Y S, He C X, et al. 24-Epibrassinolide promotes NO- 3and NH4+ ion flux rate and NRT1 gene expression in cucumber under suboptimal root zone temperature[J/OL]. BMC Plant Biology, 2019, 19(1): 225[2020-02-28]. https://doi.org/10.1186/s12870-019-1838-3.
(  0) 0) |
| [15] |
Liu C Y, Zhang F, Zhang D J, et al. Mycorrhiza stimulates root-hair growth and IAA synthesis and transport in trifoliate orange under drought stress[J]. Scientific Reports, 2018, 8(1): 1978 DOI:10.1038/s41598-018-20456-4 (  0) 0) |
| [16] |
Li L Z, Tu C, Peijnenburg W J G M, et al. Characteristics of cadmium uptake and membrane transport in roots of intact wheat (Triticum aestivum L.) seedlings[J]. Environmental Pollution, 2017, 221: 351-358 DOI:10.1016/j.envpol.2016.11.085 (  0) 0) |
| [17] |
Li L Z, Yu S Y, Peijnenburg W J G M, et al. Determining the fluxes of ions (Pb2+, Cu2+ and Cd2+) at the root surface of wetland plants using the scanning ion-selective electrode technique[J]. Plant and Soil, 2017, 414(1/2): 1-12 (  0) 0) |
| [18] |
Alloway B J. Zinc in soils and crop nutrition[M]. Brussels, Belgium: International Zinc Association, 2008.
(  0) 0) |
| [19] |
Broadley M R, White P J, Hammond J P, et al. Zinc in plants[J]. New Phytologist, 2007, 173(4): 677-702 DOI:10.1111/j.1469-8137.2007.01996.x (  0) 0) |
| [20] |
Singh O V, Labana S, Pandey G, et al. Phytoremediation: An overview of metallic ion decontamination from soil[J]. Applied Microbiology and Biotechnology, 2003, 61(5/6): 405-412 (  0) 0) |
| [21] |
彭佳师, 易红英, 龚继明.超积累植物伴矿景天镉耐受基因SpMT2的分离及功能鉴定[J/OL].生物工程学报[2019-02-28]. https://doi.org/10.13345/j.cjb.190159.
(  0) 0) |
| [22] |
吴正卓, 刘桂华, 柴冠群, 等. 伴矿景天修复镉污染土壤研究进展[J]. 山地农业生物学报, 2018, 37(6): 70-75 (  0) 0) |
| [23] |
王丽丽, 周通, 李柱, 等. 土壤紧实度对伴矿景天生长及镉锌吸收性的影响研究[J]. 土壤, 2017, 49(5): 951-957 (  0) 0) |
| [24] |
孙婷婷, 徐磊, 周静, 等. 羟基磷灰石-植物联合修复对Cu/Cd污染植物根际土壤微生物群落的影响[J]. 土壤, 2016, 48(5): 946-953 (  0) 0) |
| [25] |
刘芸君, 钟道旭, 李柱, 等. 锌镉交互作用对伴矿景天锌镉吸收性的影响[J]. 土壤, 2013, 45(4): 700-706 (  0) 0) |
| [26] |
吴龙华, 周守标, 毕德, 等. 中国景天科植物一新种—伴矿景天[J]. 土壤, 2006(5): 632-633 DOI:10.3321/j.issn:0253-9829.2006.05.022 (  0) 0) |
| [27] |
李思亮, 李娜, 徐礼生, 等. 不同生境下锌镉在伴矿景天不同叶龄叶中的富集与分布特征[J]. 土壤, 2010, 42(3): 446-452 (  0) 0) |
| [28] |
Nuccitelli R, Wilson L, Matsudaira P T. A practical guide to the study of calcium in living cells[M].
Academic Press, America, 1994
(  0) 0) |
| [29] |
Smith P J S, Hammar K, Porterfield D M, et al. Self-referencing, non-invasive, ion selective electrode for single cell detection of trans-plasma membrane calcium flux[J]. Microscopy Research and Technique, 1999, 46(6): 398-417 DOI:10.1002/(SICI)1097-0029(19990915)46:6<398::AID-JEMT8>3.0.CO;2-H (  0) 0) |
| [30] |
Kojima R, Kamata S. Zinc-selective membrane electrode using tetrabutyl thiuram disulfide neutral carrier[J]. Analytical Sciences, 1994, 10(3): 409-412 DOI:10.2116/analsci.10.409 (  0) 0) |
| [31] |
Gupta V K, Kumar A, Mangla R. Protoporphyrin IX dimethyl ester as active material in PVC matrix membranes for the fabrication of zinc (Ⅱ) selective sensor[J]. Sensors and Actuators B: Chemical, 2001, 76(1/2/3): 617-623 (  0) 0) |
| [32] |
Singh A K, Mehtab S, Singh U P, et al. Tripodal chelating ligand-based sensor for selective determination of Zn (Ⅱ) in biological and environmental samples[J]. Analytical and Bioanalytical Chemistry, 2007, 388(8): 1867-1876 DOI:10.1007/s00216-007-1434-5 (  0) 0) |
| [33] |
Shamsipur M, Rouhani S, Ganjali M R, et al. Zinc-selective membrane potentiometric sensor based on a recently synthesized benzo-substituted macrocyclic diamide[J]. Sensors and Actuators B: Chemical, 1999, 59(1): 30-34 DOI:10.1016/S0925-4005(99)00160-4 (  0) 0) |
| [34] |
Gupta V K, Agarwal S, Jakob A, et al. A zinc-selective electrode based on N, N'-bis (acetylacetone) ethylene-diimine[J]. Sensors and Actuators B: Chemical, 2006, 114(2): 812-818 DOI:10.1016/j.snb.2005.07.039 (  0) 0) |
| [35] |
Lu X, Chen Z, Hall S B, et al. Evaluation and characteristics of a Pb (Ⅱ) ion-selective electrode based on aquatic humic substances[J]. Analytica Chimica Acta, 2000, 418(2): 205-212 DOI:10.1016/S0003-2670(00)00957-0 (  0) 0) |
| [36] |
张淼, Ang S S, Nguyen V C, 等. 基于离子选择性电极的硝酸盐快速检测系统[J]. 农业工程学报, 2009, 25(S2): 235-239 (  0) 0) |
| [37] |
Wang J J, Bishop P L. Fabrication, calibration and evaluation of a phosphate ion-selective microelectrode[J]. Environmental Pollution, 2010, 158(12): 3612-3617 DOI:10.1016/j.envpol.2010.08.007 (  0) 0) |
| [38] |
Bakker E. Determination of improved selectivity coefficients of polymer membrane ion-selective electrodes by conditioning with a discriminated ion[J]. Journal of the Electrochemical Society, 1996, 143(4): L83-L85 DOI:10.1149/1.1836608 (  0) 0) |
| [39] |
Hoagland D R, Arnon D I. The water-culture method for growing plants without soil[J]. California Agricultural Experiment Station, 1950, 347(2): 32 (  0) 0) |
| [40] |
Morf W E, Ammann D, Bissig R, et al. Cation selectivity of neutral macrocyclic and nonmacrocyclic complexing agents in membranes[J]. Progress in Macrocyclic Chemistry, 1979, 1: 1-61 (  0) 0) |
| [41] |
Thoma A P, Viviani-Nauer A, Arvanitis S, et al. Mechanism of neutral carrier mediated ion transport through ion-selective bulk membranes[J]. Analytical Chemistry, 1977, 49(11): 1567-1572 DOI:10.1021/ac50019a027 (  0) 0) |
| [42] |
Ammann D, Morf W E, Anker P, et al. Neutral carrier based ion-selective electrodes[M].
Elsevier, Netherlands, 1983: 3-92
(  0) 0) |
| [43] |
Morf W E, Wuhrmann P, Simon W. Transport properties of neutral carrier on selective membranes[J]. Analytical Chemistry, 1976, 48(7): 1031-1039 DOI:10.1021/ac60371a029 (  0) 0) |
| [44] |
Van Hoof N A L M, Koevoets P L M, Hakvoort H W J, et al. Enhanced ATP-dependent copper efflux across the root cell plasma membrane in copper-tolerant Silene vulgaris[J]. Physiologia Plantarum, 2001, 113(2): 225-232 DOI:10.1034/j.1399-3054.2001.1130210.x (  0) 0) |
| [45] |
Migocka M, Papierniak A, Kosatka E, et al. Comparative study of the active cadmium efflux systems operating at the plasma membrane and tonoplast of cucumber root cells[J]. Journal of Experimental Botany, 2011, 62(14): 4903-4916 DOI:10.1093/jxb/err180 (  0) 0) |
2. Key Laboratory of Coastal Environmental Processes and Ecological Remediation, Yantai Institute of Coastal Zone Research, Chinese Academy of Sciences, Yantai, Shandong 264003, China;
3. Center for Ocean Mega-Science, Chinese Academy of Sciences, Qingdao, Shandong 266071, China;
4. Key Laboratory of Soil Environment and Pollution Remediation, Institute of Soil Science, Chinese Academy of Sciences, Nanjing 210008, China
 2020, Vol. 52
2020, Vol. 52


