我国是世界西瓜产业第一大国。2013年,我国西瓜播种面积为183万hm2,占世界西瓜栽培面积的1/2以上,总产量为7 294万t,占世界总产量的2/3以上[1]。但近年来,由于高强度、集约化种植模式导致西瓜枯萎病在我国各地普遍发生,严重者甚至绝产[2]。西瓜枯萎病是由尖孢镰刀菌西瓜专化型(Fusarium oxysporm f. sp. niveum)引起的世界性的毁灭性土传病害[3]。针对西瓜枯萎病引起的连作障碍问题,大部分农民往往采用化学药剂消毒方式来缓解和消除[4]。
“棉隆”(分子式C5H10N2S2)是一种高效、低毒、无残留的环保型广谱性综合土壤熏蒸消毒剂,目前已作为溴甲烷的替代品在植物土传病害防控中受到广泛应用[5]。当棉隆与潮湿土壤接触时,能转化成具有消毒活性的气体物质——甲基异硫氰酸脂和甲醛,经土壤间隙扩散,可以杀死所接触的生物机体。但有研究表明,棉隆熏蒸对土壤微生物,尤其是真菌,具有广谱性的杀灭作用,在杀灭病原菌的同时土壤中有益微生物数量也会降低,造成土壤微生物数量和多样性的显著降低[6-9]。棉隆熏蒸后的土壤微生物区系会形成“真空”区域,一旦恢复寄主作物的种植,病原微生物将迅速恢复其种群,继续诱发土传病害[10-11]。
土壤中单一菌种并不是作为一个独立个体存在,而是与其他微生物之间互相协同、竞争,呈现出数量与活性的正/负相关性,形成错综复杂的微生物生态网络结构,共同发挥着土壤生态功能[12-13]。基于此,微生态抗病理论近年来受到科研工作者的广泛关注,即通过特有土壤微生物区系或关键菌群抑制土传病原微生物、防控土传病害。若能通过一定的调控措施,在杀灭土传病原菌的同时增加土壤有益微生物的数量,以此来抵御病原微生物,或可克服单独土壤灭菌不足之处,达到稳定、有效防控土传病害的目的。有研究表明,向土壤中添加人工选育的拮抗菌和促生菌可以有效降低土传病害的发生率,提高作物产量[14-15]。因此,在棉隆熏蒸结束后种植作物前和种植过程中,向土壤中施用生物有机肥将能够迅速填补土壤消毒导致的微生物“真空”区域,改良土壤微生物群落结构。已有研究表明,对病害土壤进行消毒处理和生物有机肥联用可有效防控西瓜枯萎病[16]。但人工向土壤中添加的微生物属于“外来物种”,由于受到土壤及环境因素的制约,往往这些外来物种并不能在土壤中很好地存活并与土著微生物形成有效的竞争,外源接种的拮抗菌数量会随着时间的延长而迅速降低[14]。针对此问题,科研和生产上所采取的补救措施为定期向土壤中补施拮抗菌菌液[17],但若在生产过程中盲目提高生物有机肥施用频率反而会影响西瓜生产,导致肥料过量施用、土壤酸化、盐渍化等问题。
综上,本研究选取西瓜枯萎病发病严重的塑料大棚,在棉隆熏蒸土壤后联合施用不同次数生物有机肥,研究土壤消毒后种植西瓜过程中,生物有机肥施用次数对土壤理化和生物学性质及西瓜长势和产量的影响,以期获得生物有机肥最适施用频率。
1 材料与方法 1.1 试验材料供试大棚选取江苏省淮安市淮阴区温室大棚(33°31′26″N, 119°01′25″E),长为37 m,宽为8 m。该温室大棚已种植5 a,每年种植2 ~ 3茬作物,主要作物为西瓜(Citrullus lanatus),间或种植卷芯菜(Brassica oleracea L.)。该大棚上一茬种植的西瓜枯萎病发病率大于80%。大棚内土壤为砂质黏壤土。
供试生物有机肥选用“馕播王”(江阴联业生物科技有限公司),基本理化性质为:有机质439 g/kg,总氮32.4 g/kg,总氨基酸30.2 g/kg,水分301 g/kg,根际促生细菌和抗土传病害功能菌数量大于108 cfu/g。
供试西瓜品种为苏梦7号(江蔬种苗科技有限公司)。
1.2 试验设计试验共设置5个处理:无任何处理的对照(CK)、仅棉隆熏蒸(DF0)、棉隆熏蒸+移栽施用生物有机肥+追施生物有机肥1次(DF1)、棉隆熏蒸+移栽施用生物有机肥+追施生物有机肥2次(DF2)和棉隆熏蒸+移栽施用生物有机肥+追施生物有机肥3次(DF3)。棉隆熏蒸处理操作:将棉隆(江苏南通垄鑫有限公司生产)均匀施撒在土壤上,翻耕,浇水至土壤足够湿润,最后覆膜将土壤与空气隔绝。棉隆施用量为450 kg/hm2,熏蒸时间为2016年8月13日至8月27日。熏蒸结束后,揭膜,晾干土壤约1周。在种植西瓜前施用基肥,5个处理基肥种类和施用量保持一致:猪粪稻草有机肥15 t/hm2,复合肥(12-11-18)300 kg/hm2,硫酸钾75 kg/hm2。2016年9月2日移苗,移苗时DF1、DF2和DF3处理穴施生物有机肥(馕播王),用量为100 g/株。种植西瓜过程中,DF1处理在移苗后30 d追施一次馕播王(100 g/株),DF2处理分别在移苗后25、45 d追施两次馕播王(每次100 g/株),DF3处理分别在移苗后15、30、45 d追施三次馕播王(每次100 g/株)。西瓜种植方式为吊蔓垄栽,垄面宽1.2 m,沟宽0.4 m。所有处理设置3个重复小区,小区面积为6.4 m×1.2 m,小区按照随机原则排列。每个小区种植两行西瓜,每行15株,行距70 cm,株间距为20 cm。种植过程中,所有处理的田间管理措施一致。为防止边际效应,整个试验区域避开大棚周边地区,四周设置1 m保护行。
在棉隆熏蒸土壤晾干后,采集对照和棉隆熏蒸处理土壤样品,具体为:在两个处理范围内分别随机选取3个1 m × 1 m的样地采集土样,间隔距离为10 m,采样深度为0 ~ 20 cm,以土钻采样法在1 m × 1 m的样点内随机采样10 ~ 20次,均匀混合后为1个样品。在西瓜结果期,统计各处理每个小区枯萎病发病率,将感染枯萎病并表征出典型枯萎病症状的西瓜植株和感染枯萎病致死的西瓜植株分开统计。2016年11月20日种植结束,采收西瓜,统计各处理西瓜结果率、西瓜数量、总产量、单个瓜重。采收结束后,采集各处理土壤样品,具体为在各小区内随机选取10株西瓜植株,将其根系拔除后,采集土体土,采样深度为0 ~ 20 cm,均匀混合后为1个样品。采集的土样剔除石块和植物根系后,过2 mm筛,混合均匀,用塑封袋密封,分为两份,一份于4 ℃下保存用于测定土壤理化性质,一份置于-20 ℃下保存用于测定土壤微生物学性质。
1.3 样品分析 1.3.1 土壤基本性质测定土壤基本性质测定参考《土壤农化分析方法》[18]。土壤pH测定:采集的土样用蒸馏水(土水质量比1:2.5)浸提,25℃、250 r/min条件下振荡5 min,采用DMP-2mV/pH计(Mettler S220,瑞士)测定。土壤电导率EC测定:土样用蒸馏水(土水质量比1:5)浸提,25℃、250 r/min条件下振荡5 min,采用电导率仪(Leici DDS-307A,中国)测定。NH4+-N和NO3--N含量测定:用2 mol/L KCl溶液浸提(土水质量比1:5)土样,25℃、250 r/min条件下振荡1 h,用定性滤纸过滤后于4 ℃条件下保存,流动分析仪(Skalar,Breda,荷兰)测定。
1.3.2 尖孢镰刀菌、真菌和细菌的荧光定量PCR计数土壤在提取DNA前置于-20℃保存。采用PowerMax®DNA试剂盒(MO BIO Laboratories, Inc., USA)提取土壤DNA,0.5 g土壤所提取的DNA溶于100 μl洗脱溶剂中。尖孢镰刀菌、真菌和细菌数量采用CFX-96实时荧光定量PCR仪(ABI 7500, Applied Biosystems, USA)测定。荧光定量PCR扩增体系为2 μl土壤DNA模板,10 μl SYBR Premix Ex Taq,10 μmol/L正反引物各1 μl(尖孢镰刀菌为ITS1F和AFP308,细菌为Eub338和Eub518,真菌为ITS1f和5.8s,表 1),6 μl无菌去离子水。尖孢镰刀菌反应条件为95 ℃预变性2 min,95 ℃变性10 s,58 ℃退火15 s,72 ℃延伸20 s,40个循环;真菌和细菌反应条件为95 ℃预变性2 min;95 ℃变性10 s,53 ℃退火20 s,72℃延伸30 s,40个循环。在每一循环的退火阶段采集荧光信号,实时检测并且记录荧光信号的变化,反应结束后制作扩增产物的熔解曲线。建立尖孢镰刀菌、真菌和细菌标准曲线,计算土壤中尖孢镰刀菌、真菌和细菌数量。
|
|
表 1 供试引物序列 Table 1 Sequences of primers used in the study |
PCR扩增体系为1 μl土壤DNA,2.5 μl 10×DNA聚合酶缓冲液(TaKaRa),2 μl 2.5 mmol/L dNTP混合液,1.25 U DNA聚合酶(TaKaRa),10 μmol/L细菌特异性正反引物各1 μl(细菌为GC-U968和L1401,真菌为NS1和GC-Fungi,表 1),用dd H2O补足至25 μl。反应条件为95 ℃ 4 min;94 ℃变性30 s,57 ℃退火30 s,72 ℃延伸45 s,共30个循环;最后72 ℃延伸10 min。PCR反应的扩增产物用琼脂糖电泳检测。在D-Code System(Bio-Rad Laboratories Inc., Hercules, CA, USA)上进行DGGE反应。每个土壤DNA的PCR产物(10 μl)载入6%聚丙烯酰胺凝胶中(40%丙烯酰胺- bis溶液,375:1,Bio-Rad),变性梯度为40% ~ 60%。凝胶电泳在60 ℃、80 V的条件下进行16 h。
1.4 数据处理与统计分析病情指数(%)=(感染枯萎病西瓜株数×2+感染枯萎病死亡西瓜株数×5)/(西瓜总株数×5)×100%。
商品果:单个果重≥0.5 kg。商品果率(%)=商品果个数/西瓜总个数×100 %。
本文微生物数量转换成对数形式表示。PCR-DGGE反应获得的数字图像采用Quantity One软件分析。采用单因素方差分析(one-way ANOVA)与LSD检验进行处理间土壤基本性质和微生物学性质显著性差异分析(P < 0.05)。采用Pearson相关系数法进行相关性分析。上述分析在SPSS 17.0软件中完成。
2 结果与分析 2.1 种植结束后西瓜枯萎病病情指数和产量西瓜种植结束后,CK处理西瓜植株枯萎病病情指数显著高于DF(DF0、DF1、DF2和DF3)处理(P < 0.05)(表 2)。施用生物有机肥进一步降低了病情指数,且病情指数随施用生物有机肥次数的增加而降低,但各DF处理间差异不显著。由于CK处理西瓜植株大部分感染枯萎病,CK处理西瓜总产量、结果率、商品果产量和商品果率均显著低于DF处理(P < 0.05)。DF处理西瓜总产量为1 233 ~ 1 317 kg/667m2,是CK处理的2.71倍~ 2.89倍。DF处理西瓜结果率均在89%以上,最高达98.9%,是CK处理的2.43倍~ 2.69倍。与CK处理相比,DF处理中商品果产量(1 023 ~ 1 117 kg/667m2)提高3.28倍~ 3.68倍,商品果率(66.7% ~ 70.3%)增加0.41倍~ 0.48倍。施用生物有机肥处理(DF1、DF2和DF3)中西瓜总产量和结果率高于仅棉隆熏蒸处理(DF0),但差异不显著。
|
|
表 2 西瓜种植结束后各处理西瓜枯萎病病情指数和产量指标 Table 2 Disease index of watermelon wilt and watermelon yields under different treatments after planting |
棉隆熏蒸结束后,与CK处理(7.07 lg ITS基因拷贝数/g干土)相比,DF处理土壤中尖孢镰刀菌数量显著降低至4.25 lg ITS基因拷贝数/g干土(图 1A) (P < 0.05),尖孢镰刀菌杀灭率达99.8%。DF处理土壤中细菌数量基本未改变(图 1B),真菌数量从CK处理的7.81 lg ITS基因拷贝数/g干土降低至7.48 lg ITS基因拷贝数/g干土(图 1C),减少了53.6%。与CK处理相比(48.1),DF处理土壤细菌数量/真菌数量比值(B/F)显著增加至97.7(图 1D)。同时,DF处理中尖孢镰刀菌数量/真菌数量比值(FO/F)(0.001)显著低于CK处理(0.133)(图 1E)。
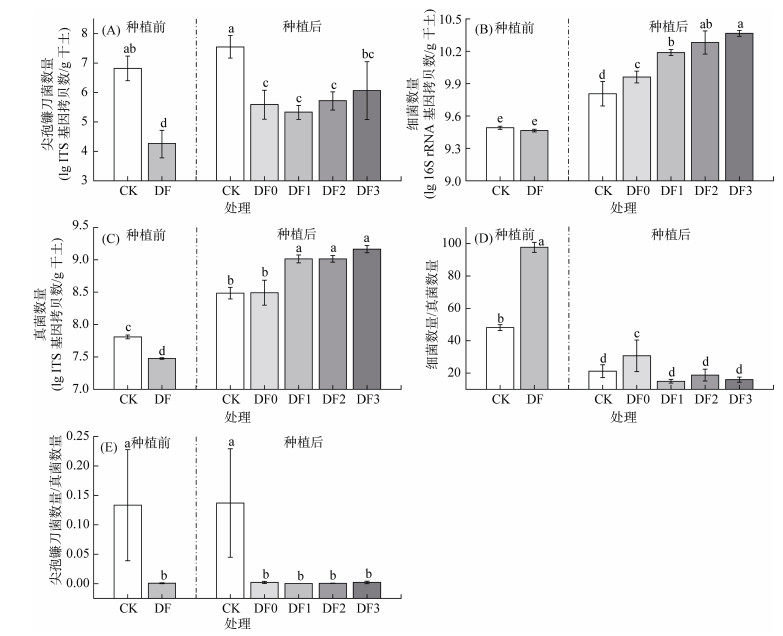
|
(图中不同小写字母表示处理间差异显著(P < 0.05);下同) 图 1 西瓜种植前后不同处理土壤微生物性质变化 Fig. 1 Soil microbial properties under different treatments before and after watermelon planting |
种植西瓜过程中,各处理土壤中尖孢镰刀菌、细菌和真菌数量均显著增加(P < 0.05)。种植结束后,DF处理中尖孢镰刀菌数量增加至5.58 ~ 6.06 lg ITS基因拷贝数/g干土,仍显著低于CK处理(7.55 lg ITS基因拷贝数/g干土)。DF处理间尖孢镰刀菌数量差异不显著(图 1A)。DF处理细菌数量(9.96 ~ 10.37 lg 16S rRNA基因拷贝数/g干土)显著高于CK处理(9.81 lg 16S rRNA基因拷贝数/g干土)(图 1B)。同时,施用生物有机肥处理中细菌数量显著高于DF0处理,且土壤细菌数量随生物有机肥施用次数增加而增加(r=0.915,P < 0.01)(表 3)。施用生物有机肥处理土壤真菌数量(9.01 ~ 9.16 lg ITS基因拷贝数/g干土)显著高于CK和DF0处理(8.48 ~ 8.49 lg ITS基因拷贝数/g干土)(图 1C)。DF处理间真菌数量与生物有机肥施用次数呈显著正相关关系(r=0.835,P < 0.01)(表 3)。各处理土壤中B/F值均显著降低,FO/F值基本保持不变(图 1D和图 1E)。CK处理和施用生物有机肥处理中B/F值(15.0 ~ 21.2)显著低于DF0处理(30.7)。DF处理FO/F值(0.000 ~ 0.002)显著低于CK(0.137),DF处理间差异不显著。所有处理间,作物病情指数与尖孢镰刀菌数量(r=0.783,P < 0.01)和FO/F比值(r= 0.857,P < 0.01)呈显著正相关关系,与细菌数量(r= -0.727,P < 0.01)呈显著负相关关系(表 4)。
|
|
表 3 种植结束后棉隆处理间生物有机肥施用次数与土壤生化性质相关关系 Table 3 Correlations between the application times of bioorganic fertilizer and soil biochemical properties among dazomet fumigation treatments after watermelon planting |
|
|
表 4 种植结束后所有处理间微生物与植株产量指标的相关关系 Table 4 Correlations between microbial indexes and watermelon agronomic traits after planting |
聚丙烯酰胺凝胶电泳(DGGE)结果表明,CK和施用生物有机肥处理的细菌条带数明显多于DF0处理,各泳道条带位置的差异表明不同处理土壤细菌和真菌组成有明显差别(图 2)。UPGAMA聚类分析结果进一步表明,与CK相比,DF处理明显改变了土壤细菌和真菌群落结构。此外,施用生物有机肥处理细菌群落结构明显区别于DF0处理(图 3A);与DF0和DF1处理相比,追施2次及以上生物有机肥处理对真菌群落结构改变更大(图 3B)。
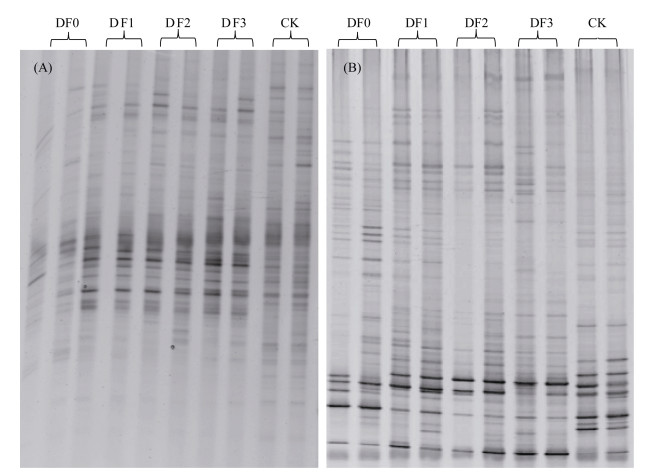
|
图 2 种植一茬西瓜后各处理细菌(A)和真菌(B)DGGE图谱 Fig. 2 Bacterial (A) and fungal (B) DGGE maps under different treatments after watermelon planting |

|
图 3 种植一茬西瓜后各处理细菌(A)和真菌(B)群落UPGAMA聚类分析 Fig. 3 UPGAMA clustering analysis of bacterial (A) and fungal (B) communities under different treatments after watermelon planting |
棉隆熏蒸结束后,土壤pH、EC和NO3--N含量基本保持不变,NH4+-N含量略有上升,但与CK相比差异不显著(图 4)。种植西瓜结束后,各处理土壤pH均显著降低,EC值、NH4+-N和NO3--N含量均显著增加(P < 0.05)(图 4)。种植结束后,CK处理pH(5.74)显著高于DF处理(4.58 ~ 5.09),施用生物有机肥处理pH显著低于DF0处理(图 4A)。CK和DF0处理间EC值(1.64 ~ 1.85 mS/cm)差异不显著,但显著低于施用生物有机肥处理(2.17 ~ 2.46 mS/cm),EC值随生物有机肥施用次数增加而增加,但差异不显著(图 4B)。DF处理NH4+-N含量(247 ~ 285 mg/kg)均高于CK(215 mg/kg),其中DF1处理NH4+-N含量显著高于CK(图 4C)。CK、DF0和DF1处理间NO3--N含量(304 ~ 403 mg/kg)差异不显著,但显著低于DF2和DF3处理(597 ~ 646 mg/kg)(图 4D),土壤NO3--N含量随生物有机肥追施次数增加而增高。各DF处理间,生物有机肥施用次数与土壤pH呈显著负相关关系(r=-0.754,P < 0.01),与EC(r=0.720,P < 0.01)和NO3-含量(r=0.833,P < 0.01)呈显著正相关关系(表 3)。
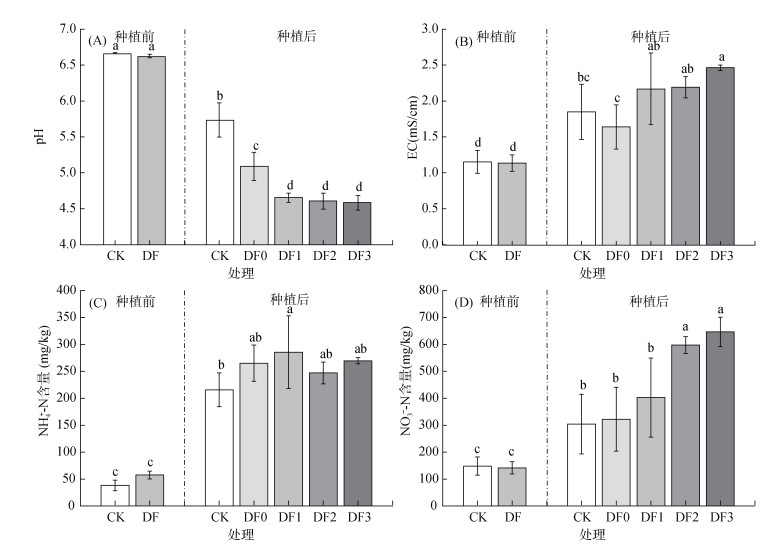
|
图 4 西瓜种植前后不同处理土壤理化性质变化 Fig. 4 Soil physicochemical properties under different treatments after watermelon planting |
棉隆熏蒸处理显著降低了西瓜枯萎病发病率。前期研究表明,棉隆熏蒸可以有效防治土壤连作导致的土传疾病,如甜瓜枯萎病[27]、辣椒疫病[29]和番薯根腐病等[28]。曹云等[16]研究表明,与对照相比(85.6%),棉隆熏蒸处理西瓜枯萎病发病率显著降低至45.9%,结合单次施用生物有机肥后发病率进一步降低至34.2%。本试验结果中,施用生物有机肥未进一步降低西瓜枯萎病发病率,这可能是由于仅棉隆熏蒸处理本身西瓜枯萎病发病率很低的缘故(12.0%)。
本试验结果表明,棉隆熏蒸可以高效杀灭土壤中的病原菌,显著降低土壤真菌数量,但基本不改变细菌数量。余宏军等[29]研究也表明,棉隆熏蒸剂对栽培基质中尖孢镰刀菌杀灭率达99.0%以上。胡兰等[8]研究表明,棉隆熏蒸后土壤真菌数量显著低于未熏蒸处理。有研究表明棉隆熏蒸可显著降低土壤细菌数量[30-31],但也有结果表明棉隆熏蒸后土壤细菌数量无显著变化[32]。造成细菌数量变化不同的原因可能与不同研究中土壤性质、试验条件、棉隆熏蒸剂量和时间不同有关。由于棉隆熏蒸后,土壤真菌数量显著降低,细菌数量保持不变,因此土壤中B/F比值显著增加。有研究表明,土壤中B/F值越高,越利于植物生长[33-34]。
本研究西瓜种植结束后,各处理尖孢镰刀菌数量均有增加,其中DF处理尖孢镰刀菌数量增加显著,其增加量高于CK处理。Huang等[35]研究结果表明,消毒土壤上种植作物后病原菌数量增长速率高于未消毒土壤。当恢复寄主作物种植后,消毒土壤中适宜的土壤环境有利于病原菌迅速生长;而由于种内竞争作用,原本病原菌数量已很高的对照土壤中病原菌增长速率反而低于消毒土壤[10-11]。但本研究西瓜种植结束后,DF处理尖孢镰刀菌数量仍显著低于熏蒸前土壤尖孢镰刀菌数量,同时,DF处理种植前后FO/F比值(尖孢镰刀菌相对含量)未改变。土壤中病原菌含量(包括绝对含量和相对含量)是影响植株是否感病的直接因素[36]。本研究结果也表明,西瓜枯萎病病情指数分别与尖孢镰刀菌数量和尖孢镰刀菌相对含量之间有显著正相关关系(表 4)。由于作物健康状况直接影响其产量,因此处理间各产量指标也分别与尖孢镰刀菌数量和尖孢镰刀菌相对含量之间呈显著负相关关系(表 4)。种植西瓜过程中施用生物有机肥未降低土壤尖孢镰刀菌数量,但显著提高了土壤细菌和真菌数量。本试验中所用生物有机肥“馕播王”中的功能菌为芽孢杆菌和木霉菌,施用后可提高土壤细菌、真菌数量,同时,土壤细菌数量随生物有机肥施用次数增加而增加。有研究表明提高土壤细菌数量对尖孢镰刀菌有抑制作用[37]。本研究结果也表明细菌数量和病情指数间呈显著负相关关系。此外,DF处理土壤细菌和真菌群落结构均明显不同于CK土壤。除了有效杀灭土壤病原菌外,通过一定途径改变土壤原有微生物区系、提高某些微生物菌群数量和活性也是抑制土传病原微生物活性、防控土传病害的重要途径之一[36, 38]。因此,棉隆熏蒸处理后土壤原有微生物区系发生改变可能也是其有效防控西瓜枯萎病的重要原因。施用生物有机肥进一步改变了土壤细菌和真菌群落结构,其中多次追施生物有机肥处理(2次及以上)对病害土壤真菌群落结构改变更大。本试验结果未显示施用生物有机肥对西瓜枯萎病的进一步防控效果,但施用生物有机肥提高了土壤细菌数量并推动了土壤细菌和真菌群落结构发生变化,或对病害防控有促进效果,需进一步试验证明。
本研究棉隆熏蒸结束后,土壤理化性质(包括pH、EC、NH4+-N和NO3--N含量)不变。这是由于棉隆药剂与潮湿土壤接触后转化成的土壤消毒活性物质(甲基异硫氰酸脂及少量的甲醛和硫化氢)在后期揭膜晾晒过程中会快速散逸,不影响土壤理化性质。种植西瓜后,与CK处理相比,DF0处理土壤EC值、NH4+-N和NO3--N含量基本不变,pH显著降低。燕平梅等[39]研究结果也表明,棉隆熏蒸土壤100 d后土壤NH4+-N和NO3--N含量与未熏蒸土壤相比未有显著变化。有研究表明,在种植作物过程中棉隆熏蒸土壤pH显著高于对照土壤[39],造成相反试验结果的原因可能与两者试验中土壤性质和试验条件不同有关。施用生物有机肥进一步降低了土壤pH,且多次追施生物有机肥(2次及以上)显著增加了EC和NO3--N含量。随着微生物肥料的施用,大量氨基酸肥和无机氮被施入土壤。设施大棚内较高的土温和施用大量氮肥会促进硝化作用,有机肥和NH4+-N肥施入土壤后将很快转化为NO3--N[40]。因此,DF处理间NH4+-N含量差异不显著,而NO3--N含量随生物有机肥施用次数的增加而增加(表 3)。本试验中,DF处理间生物有机肥施用次数与土壤pH呈显著负相关,与EC呈显著正相关(表 3)。这是由于硝化作用会释放大量H+,导致土壤pH降低,而累积的NO3--N直接导致土壤盐分增加、EC值增高[41-43]。
4 结论棉隆熏蒸可有效杀灭土壤中尖孢镰刀菌并显著降低西瓜枯萎病发病率,但不影响土壤理化性质。棉隆熏蒸土壤在种植西瓜过程中,施用生物有机肥并未减缓尖孢镰刀菌增长速率、降低枯萎病发病率,但显著增加了土壤细菌和真菌数量,改变了细菌和真菌群落结构。此外,过量施用生物有机肥会降低土壤pH,并导致土壤NO3--N累积、盐分增加。从改良土壤微生物群落、减少NO3--N累积和经济效益角度出发,棉隆熏蒸后土壤在种植西瓜过程中生物有机肥最佳施用方式为移栽时施用1次+种植过程中追施1 ~ 2次。
| [1] |
刘文革, 何楠, 赵胜杰, 等. 我国西瓜品种选育研究进展[J]. 中国瓜菜, 2016, 29(1): 1-7 DOI:10.3969/j.issn.1673-2871.2016.01.001 (  0) 0) |
| [2] |
张屹, 魏林, 许勇, 等. 西瓜枯萎病的研究进展[J]. 湖南农业科学, 2013(5): 67-70 DOI:10.3969/j.issn.1006-060X.2013.05.020 (  0) 0) |
| [3] |
Zhang Z G, Zhang J Y, Wang Y C, et al. Molecular detection of Fusarium oxysporum F.SP. niveum and Mycosphaerella melonis in infected plant tissues and soil[J]. Fems Microbiology Letters, 2005, 249(1): 39-47 DOI:10.1016/j.femsle.2005.05.057 (  0) 0) |
| [4] |
张树生, 杨兴明, 茆泽圣, 等. 连作土灭菌对黄瓜(Cucumis sativus)生长和土壤微生物区系的影响[J]. 生态学报, 2007, 27(5): 1809-1817 DOI:10.3321/j.issn:1000-0933.2007.05.017 (  0) 0) |
| [5] |
周大纲. 甲基溴的取代药剂——棉隆[J]. 世界农药, 2011, 33(3): 46-49 DOI:10.3969/j.issn.1009-6485.2011.03.011 (  0) 0) |
| [6] |
Stromberger M E, Klose S, Ajwa H A, et al. Microbial populations and enzyme activities in soils fumigated with methyl bromide alternatives[J]. Soil Science Society of America Journal, 2005, 69(6): 1987-1999 DOI:10.2136/sssaj2005.0076 (  0) 0) |
| [7] |
Bonanomi G, Chiurazzi M, Caporaso S, et al. Soil solarization with biodegradable materials and its impact on soil microbial communities[J]. Soil Biology & Biochemistry, 2008, 40(8): 1989-1998 (  0) 0) |
| [8] |
胡兰, 杨威, 徐婧, 等. 棉隆与生化黄腐酸对设施土壤真菌多样性的影响[J]. 沈阳农业大学学报, 2014, 45(2): 217-220 DOI:10.3969/j.issn.1000-1700.2014.02.019 (  0) 0) |
| [9] |
张超, 卜东欣, 张鑫, 等. 棉隆对辣椒疫霉病的防效及对土壤微生物群落的影响[J]. 植物保护学报, 2015, 42(5): 834-840 (  0) 0) |
| [10] |
Zhao Q Y, Shen Q R, Ran W, et al. Inoculation of soil by Bacillus subtilis Y-IVI improves plant growth and colonization of the rhizosphere and interior tissues of muskmelon (Cucumis melo L.)[J]. Biology and Fertility of Soils, 2011, 47(5): 507-514 DOI:10.1007/s00374-011-0558-0 (  0) 0) |
| [11] |
Qiu M H, Zhang R F, Xue C, et al. Application of bio-organic fertilizer can control Fusarium wilt of cucumber plants by regulating microbial community of rhizosphere soil[J]. Biology and Fertility of Soils, 2012, 48(7): 807-816 DOI:10.1007/s00374-012-0675-4 (  0) 0) |
| [12] |
蔡祖聪, 黄新琦. 土壤学不应忽视对作物土传病原微生物的研究[J]. 土壤学报, 2016, 53(2): 305-310 (  0) 0) |
| [13] |
Zhou J Z, Deng Y, Luo F, et al. Functional molecular ecological networks[J]. mBio, 2010, 1(4): e00169-10 (  0) 0) |
| [14] |
张杨, 王甜甜, 孙玉涵, 等. 西瓜根际促生菌筛选及生物育苗基质研制[J]. 土壤学报, 2017, 54(3): 703-712 (  0) 0) |
| [15] |
李想, 刘艳霞, 陆宁, 等. 综合生物防控烟草青枯病及其对土壤微生物群落结构的影响[J]. 土壤学报, 2017, 54(1): 216-226 (  0) 0) |
| [16] |
曹云, 宋修超, 郭德杰, 等. 棉隆熏蒸与微生物有机肥联用对西瓜枯萎病的防控研究[J]. 土壤, 2018, 50(1): 93-100 (  0) 0) |
| [17] |
Lo C T, Nelson E B, Harman G. Improved biocontrol efficacy of trichoderma harzianum 1295-22 for foliar phases of turf diseases by use of spray applications[J]. Plant Disease, 1997, 81(10): 1132-1138 DOI:10.1094/PDIS.1997.81.10.1132 (  0) 0) |
| [18] |
鲁如坤, 时正元, 赖庆旺. 红壤养分退化研究(Ⅱ)──尿素和碳铵在红壤中的转化[J]. 土壤通报, 1995, 26(6): 241-243 (  0) 0) |
| [19] |
Lane D. 16s/23s rRNA sequencing[M]. John Wiley and Sons, West Sussex, United Kingdom, 1991: 115-175.
(  0) 0) |
| [20] |
Muyzer G, de Waal E C, Uitterlinden A A G. Profiling of complex microbial populations by denaturing gradient gel electrophoresis analysis of polymerase chain reaction-amplified genes coding for 16S rRNA[J]. Applied and Environmental Microbiology, 1993, 59(3): 695-700 (  0) 0) |
| [21] |
Gardes M, Bruns T D. ITS primers with enhanced specificity for basidiomycetes——application to the identification of mycorrhizae and rusts[J]. Molecular Ecology, 1993, 2(2): 113-118 (  0) 0) |
| [22] |
Vilgalys R, Hester M. Rapid genetic identification and mapping of enzymatically amplified ribosomal DNA from several Cryptococcus species[J]. Journal of Bacteriology, 1990, 172(8): 4238-4246 DOI:10.1128/JB.172.8.4238-4246.1990 (  0) 0) |
| [23] |
Lievens B, Brouwer M, Vanachter A C R C, et al. Quantitative assessment of phytopathogenic fungi in various substrates using a DNA macroarray[J]. Environmental Microbiology, 2005, 7(11): 1698-1710 DOI:10.1111/j.1462-2920.2005.00816.x (  0) 0) |
| [24] |
Zoetendal E G, Akkermans A D L, de Vos W M. Temperature gradient gel electrophoresis analysis of 16S rRNA from human fecal samples reveals stable and host-specific communities of active bacteria[J]. Applied and Environmental Microbiology, 1998, 64(10): 3854-3859 DOI:10.1128/AEM.64.10.3854-3859.1998 (  0) 0) |
| [25] |
White T, Bruns T, Lee S, et al. Amplification and direct sequencing of fungal ribosomal RNA genes for phylogenetics[M]//Innis M A, Gelfand D H, Sninsky J J, et al. PCR Protocols: A Guide to Methods and Applications. New York: Academic Press, Inc, 1990, 315- 322.
(  0) 0) |
| [26] |
May L A, Smiley B, Schmidt M G. Comparative denaturing gradient gel electrophoresis analysis of fungal communities associated with whole plant corn silage[J]. Canadian Journal of Microbiology, 2001, 47(9): 829-841 DOI:10.1139/w01-086 (  0) 0) |
| [27] |
何舰. 98%棉隆防治甜瓜枯萎病试验[J]. 农业开发与装备, 2015(10): 92 DOI:10.3969/j.issn.1673-9205.2015.10.079 (  0) 0) |
| [28] |
乔岩, 董杰, 王品舒, 等. 不同土壤消毒药剂对甘薯2种土传病害的防治效果[J]. 河南农业科学, 2017, 46(8): 92-95 (  0) 0) |
| [29] |
余宏军, 吕雅悠, 李强, 等. 不同熏蒸剂杀灭无土栽培基质中尖孢镰刀菌的效果评价[J]. 中国蔬菜, 2017(3): 46-51 (  0) 0) |
| [30] |
刘恩太, 李园园, 胡艳丽, 等. 棉隆对苹果连作土壤微生物及平邑甜茶幼苗生长的影响[J]. 生态学报, 2014, 34(4): 847-852 (  0) 0) |
| [31] |
范琳娟, 刘奇志, 宋兆欣, 等. 温室重茬草莓土壤施用棉隆和氯化苦效果评价[J]. 农药, 2017, 56(4): 293-296 (  0) 0) |
| [32] |
刘超, 相立, 王森, 等. 土壤熏蒸剂棉隆加海藻菌肥对苹果连作土微生物及平邑甜茶生长的影响[J]. 园艺学报, 2016, 43(10): 1995-2002 (  0) 0) |
| [33] |
孙秀山, 封海胜, 万书波, 等. 连作花生田主要微生物类群与土壤酶活性变化及其交互作用[J]. 作物学报, 2001, 27(5): 617-621 DOI:10.3321/j.issn:0496-3490.2001.05.010 (  0) 0) |
| [34] |
吴海燕, 范作伟, 刘春光, 等. 保护性耕作条件下玉米田土壤微生物区系变化与影响因素分析[J]. 玉米科学, 2008, 16(4): 135-139 (  0) 0) |
| [35] |
Huang X Q, Wen T, Zhang J B, et al. Control of soil-borne pathogen Fusarium oxysporum by biological soil disinfestation with incorporation of various organic matters[J]. European Journal of Plant Pathology, 2015, 143(2): 223-235 DOI:10.1007/s10658-015-0676-x (  0) 0) |
| [36] |
Berendsen R L, Pieterse C M J, Bakker P A H M. The rhizosphere microbiome and plant health[J]. Trends in Plant Science, 2012, 17(8): 478-486 DOI:10.1016/j.tplants.2012.04.001 (  0) 0) |
| [37] |
卓国豪, 黄有宝, 吴运新, 等. 香蕉枯萎病的综合防治技术[J]. 植物检疫, 2003, 17(5): 279-280 DOI:10.3969/j.issn.1005-2755.2003.05.007 (  0) 0) |
| [38] |
Alabouvette C. Fusarium wilt suppressive soils: an example of disease-suppressive soils[J]. Australasian Plant Pathology, 1999, 28(1): 57-64 DOI:10.1071/AP99008 (  0) 0) |
| [39] |
燕平梅, 高贵喜, 曹坳程, 等. 土壤熏蒸剂对土壤硝化、反硝化作用的影响[J]. 中国生态农业学报, 2014, 22(4): 401-407 (  0) 0) |
| [40] |
钱海燕, 王兴祥, 黄国勤, 等. 施肥对连作蔬菜地蔬菜产量和土壤氮素含量的影响[J]. 中国农学通报, 2008, 24(7): 270-275 (  0) 0) |
| [41] |
寇长林, 巨晓棠, 高强, 等. 两种农作体系施肥对土壤质量的影响[J]. 生态学报, 2004, 24(11): 2548-2556 DOI:10.3321/j.issn:1000-0933.2004.11.028 (  0) 0) |
| [42] |
孙志梅, 武志杰, 陈利军, 等. 农业生产中的氮肥施用现状及其环境效应研究进展[J]. 土壤通报, 2006, 37(4): 782-786 DOI:10.3321/j.issn:0564-3945.2006.04.037 (  0) 0) |
| [43] |
沈灵凤, 白玲玉, 曾希柏, 等. 施肥对设施菜地土壤硝态氮累积及pH的影响[J]. 农业环境科学学报, 2012, 31(7): 1350-1356 (  0) 0) |
 2020, Vol. 52
2020, Vol. 52


