在陆地生态系统中,土壤酶主要来源于高等植物根系、土壤动物以及土壤微生物的分泌作用,是一类具有高度催化作用的蛋白质。研究表明,水解酶通过作用于有机化合物中的糖苷键、脂键、肽键、酸酐键等来降解淀粉、纤维素、半纤维素、多肽物质、几丁质、磷酸酯类等物质,将大分子有机化合物分解为能容易被土壤微生物利用和植物吸收的小分子化合物[1]。鉴于土壤水解酶可以催化降解土壤有机质,在参与土壤碳、氮、磷转化的过程中起重要作用,因此被用作指示土壤质量的指标,已被国内外众多科研工作者应用于研究不同类型的生态系统[2]。土壤酶活性受到土壤中物理、化学和生物因素的影响,是多种因素交互作用的结果[3]。此外由于土壤酶的专一性和高度敏感性,使土壤酶活性表现出一定的空间和时间差异性,同时酶活性的大小能够表征其所控制的酶促反应的方向和强度,所以通过研究酶活性一方面能比较不同区域的土壤环境特征,评价不同区域的土壤质量水平,另一方面能够反映土壤碳、氮和磷等物质转化的情况,进而评估土壤营养物质的周转,揭示酶活性在调节土壤营养供给方面的重要作用。
土壤中含有多种不同种类的水解酶,但主要归结为参与土壤碳转化的酶(α-1, 4-葡萄糖苷酶α-1, 4- glucosidase,AG;β-1, 4-葡萄糖苷酶β-glucosidase,BG;纤维素酶Cellulase,CB;木聚糖酶Xylanase,XYL)、参与土壤氮转化的酶(亮氨酸氨基肽酶Leucine aminopeptidase,LAP;β-1, 4-N-乙酰氨基葡萄糖苷酶N-acetyl-β-D-glucosaminidase,NAG)和参与磷转化的酶(磷酸酶Phosphat ase,PHOS)。土壤水解酶活性不仅与土壤有机质组成密切相关,还受到土壤pH、土壤速效养分含量的影响[4-5]。大量关于施肥对水解酶活性影响的研究表明,化肥或有机肥施用能一定程度提高土壤水解酶活性,或影响较小,且不同的水解酶对施肥的响应不一致[6-9]。例如,田善义等[9]研究结果显示,单施化肥(NPK)、单施有机肥(OM)及化肥有机肥配施(NPKM)处理均不同程度提高参与碳、氮转化的酶活性,其中NPK处理的XYL酶活性最高,LAP酶活性与CK无显著差异。以往的研究主要集中在阐明不同施肥处理下土壤酶活性的变化情况,以及探讨土壤养分等性质与酶活性的相关关系,但各自独立的土壤酶对外界响应的变化并不能完全说明土壤酶活性变化的本质与关联。通过将不同土壤酶的活性变化耦联起来(即土壤酶之间活性大小的相对变化)可进一步揭示在营养环境变化时,不同土壤水解酶的响应差异及其内在联系。
土壤微生物作为土壤水解酶的主要生产者,其在合成分泌酶的过程中以成本效益为基本原则[3],即根据外界养分物质或底物数量的变化减少某些土壤酶分泌,同时增加另一些土壤酶的分泌,即微生物根据外界环境变化和对不同营养物质的需求不同,进而调控不同类型土壤酶的活性变化,用最小的消耗获取最大的利益。施用肥料带入到土壤中的大量速效养分是调控酶活性的重要影响因子,可引发土壤微生物的负反馈调节来影响微生物分泌不同酶的能力,从而控制酶活性[10]。有机肥中的物质组成复杂,在改善土壤质量方面有着突出的作用,能刺激微生物生长并引发微生物对营养物质的需求,同时微生物分泌土壤酶催化土壤中各种物质的合成与降解过程,直接或间接影响着生态系统的物质循环与功能的发挥[11]。
为研究土壤水解酶对不同施肥响应的差异以及进一步验证养分对酶活性的负反馈调节,本研究采用室内培养方法,通过分别施加有机、无机肥,动态监测碳氮磷水解酶活性,利用冗余分析(redundancy analysis,RDA)以及非度量多维度尺度分析(nonmetric multidimensional scaling,NMDS)[12]进一步揭示土壤水解酶活性与速效养分的反馈关系以及土壤水解酶活性响应差异的影响因素。
1 材料与方法 1.1 试验材料土壤采自江西省红壤生态研究所典型农田旱地红壤(R);牛粪商品有机肥(C)为牛粪与稻壳按质量比3.5︰1(碳氮比为25)堆制而成;化肥(NPK)为尿素、磷酸二氢钙、氯化钾。土壤与有机肥的基本性状见表 1。
|
|
表 1 试验材料的基本性质 Table 1 Basic properties of tested materials |
本试验设置3个处理,每个处理3次重复:①红壤+牛粪有机肥(R+C);②红壤+化肥(R+NPK);③红壤不添加肥料(对照,R)。
1.3 材料预处理与培养采样将土壤样品与商品有机肥过20目网筛,按照C 3 g/kg (干土)的标准添加牛粪有机肥,化肥的添加量按照所添加有机肥中的氮磷钾含量等量加入。调整土壤含水率至田间持水量的60%(按照干基计算含水率)。将混合后的土壤分装于培养瓶中,放置在25 ℃培养箱中培养,每周加水保持含水率不变。分别在5、30和90 d进行破坏性采样。
采样时将土壤混合均匀后,一部分土壤样品存放于4 ℃冰箱用于土壤酶活性、土壤基础呼吸、可溶性有机碳和速效氮(铵态氮和硝态氮)等指标测定,另一部分土壤样品风干后过筛用于土壤pH、有效磷的测定。
1.4 分析方法土壤基本性状采用常规方法测定[13]。土壤pH:1︰2.5(土︰水,m︰V),pH计(HANNA,HI2221)测定;有效磷:HCl-NH4F提取,钼锑抗比色法测定;土壤速效氮使用2 mol/L KCl提取,连续流动分析仪测定(SEAL-AA3,德国)。
可溶性有机碳,使用纯水提取,总有机碳分析仪(Elementar Vario EL Ⅲ,德国)测定。土壤呼吸采用培养法,气相色谱法测定。
土壤水解酶活性测定采用微孔板荧光法[14-15]。利用荧光物质4-羟甲基-7-香豆素(MUB)共轭物质作为测定底物,接种土壤悬液至96孔微孔板中,测定具有代表性酶活性,包括4种参与碳转化的酶(α-1, 4-
葡萄糖苷酶、β-1, 4-葡萄糖苷酶、纤维素酶、木聚糖酶),2种参与氮转化的酶(亮氨酸氨基肽酶、β-1, 4-N-乙酰氨基葡萄糖苷酶)和1种参与磷转化的酶(磷酸酶),用每小时每克样品的基质转化率表示样品酶活性(nmol/(g·h))。
总酶活性(total enzyme activities,TEA)[16],该指标的构建消除不同酶活性的类别、量纲及大小的影响来指示土壤总体酶活性水平,计算公式如下:
| $ {\rm{THA = }}n\sqrt {\prod\limits_{i = 1}^n {{\rm{ln}}} } {E_i} $ |
式中:Ei为单一酶活性的测定值。i代表不同类型酶,本研究共测定7种酶(n = 7,即i=1, …, n)。
1.5 数据处理采用重复测量方差分析评价不同施肥方式、培养时间及两者交互的影响,并用Tukey HSD方法进行多重比较。为评估酶活性对不同环境的响应情况,将酶活性的原始数据经对数(log10)转化后,计算每种酶的相对比例,用于非度量多维尺度分析。冗余分析用于检验处理、酶活性和理化性质三者之间的关系,以及不同处理之间的差异性。数据分析及绘图均使用R software (version 3.5.0)。
2 结果与分析 2.1 不同施肥处理对土壤化学性质的影响重复测量方差分析结果显示(表 2),土壤添加有机肥(R+C)或化肥(R+NPK)后对土壤pH、土壤呼吸、可溶性有机碳、速效氮、有效磷有极显著的影响(P < 0.001)。此外,不同培养时间对土壤呼吸、可溶性有机碳、速效氮、有效磷有显著影响。处理与时间的交互对土壤呼吸、速效氮也有显著影响。
|
|
表 2 不同培养时间下,添加有机肥或化肥对土壤化学性质影响的重复测量方差分析 Table 2 Repeat ANOVAs on effects of adding organic amendment or chemical fertilizer on soil properties under different incubation times |
与对照相比,有机肥能显著提高土壤pH,而化肥则显著降低土壤pH(P < 0.05);3个处理在不同采样时间的pH并没有发生显著变化(表 3)。在5 d时,有机肥能显著提高土壤呼吸速率,但随着培养时间的延长,这种促进作用逐渐减弱,到30 d时各处理间无显著性差异。有机肥处理在每个采样时间的可溶性有机碳含量均显著高于其他处理;随着时间增加,可溶性有机碳含量逐渐降低,在90 d时相对于5 d,有机肥、化肥和对照处理的可溶性有机碳含量分别下降8.68%、28.18%、38.87%。化肥处理在每个采样时间均保持最高的速效氮含量,在90 d时相对于5 d,有机肥、化肥和对照处理的速效氮含量分别升高162.53%、35.26%、122.84%。有机肥、化肥处理与对照处理相比,在3个采样时间均能显著提高有效磷含量,且随培养时间增加,有效磷含量有升高的趋势,在90 d时相对于5 d,有机肥、化肥处理和对照处理有效磷含量分别升高23.47%、42.84%、35.01%(表 3)。
|
|
表 3 不同培养时间下,添加有机肥或化肥对土壤化学性质的影响 Table 3 Effects of adding organic amendment or chemical fertilizer on soil prop |
土壤水解酶活性的重复测量方差分析结果(表 4)显示:施肥处理对β-1, 4-葡萄糖苷酶、纤维素酶、木聚糖酶活性没有显著影响,但培养时间对其有显著影响;此外,处理与时间的交互对木聚糖酶活性有显著影响。处理、时间以及处理与时间的交互对α-1, 4-葡萄糖苷酶活性均有显著影响,以上4种土壤酶主要与土壤碳转化有关。处理、处理与时间的交互对亮氨酸氨基肽酶活性有显著影响,处理、时间分别对β-1, 4-N-乙酰氨基葡萄糖苷酶活性有显著影响,这两种土壤酶与土壤氮转化有关。磷酸酶活性与土壤磷转化有关,处理与时间分别显著影响其活性。处理、时间及处理与时间的交互对总酶活性均有显著影响。
|
|
表 4 土壤酶活性的重复测量方差分析 Table 4 Repeat ANOVAs results (F values and Probability level) of soil hydrolase activities |
从图 1结果可以看出,参与碳转化的水解酶中,β-1, 4-葡萄糖苷酶活性最高、其次为纤维素酶,木聚糖酶和α-1, 4-葡萄糖苷酶活性较低。β-1, 4-葡萄糖苷酶、纤维素酶、木聚糖酶这3种水解酶活性对施肥响应不敏感,前2次采样时期处理间均无显著性差异,只是90 d时添加有机肥处理的这3种酶活性与对照相比显著降低,与无机肥处理相比无显著差异;且无机肥处理与对照间也无显著性差异。然而,α-1, 4-葡萄糖苷酶活性对不同施肥处理具有相反的响应特征;前2个时期,施加有机肥显著增加了α-1, 4-葡萄糖苷酶活性,而后又显著低于对照处理;但化肥处理在5 d时与对照没有明显差异,而后的2个时期则显著低于对照处理。这表明α-1, 4-葡萄糖苷酶活性对施肥的敏感性较强,且对施加有机肥和无机肥的响应不同。
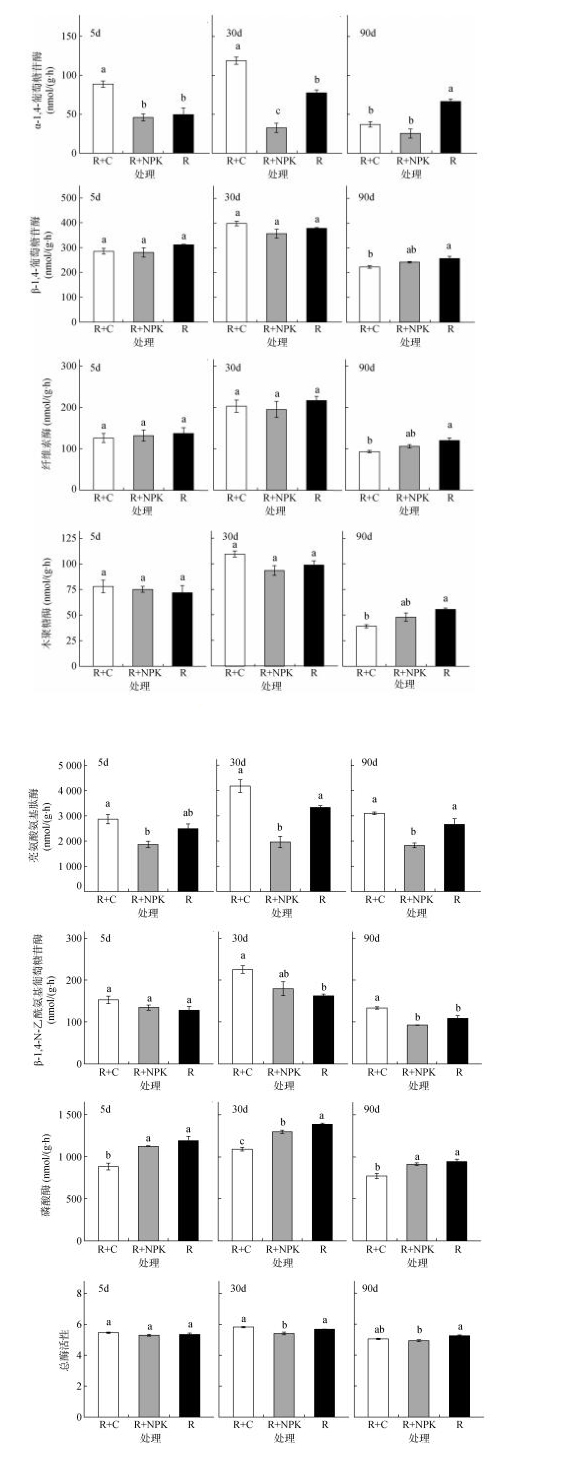
|
(图中小写字母不同表示同一培养时间内不同处理之间显著差异(P < 0.05) 图 1 不同培养时间下,添加有机肥或化肥对土壤酶活性的影响 Fig. 1 Effects of organic amendment or chemical fertilizer on soil hydrolase activities |
氮转化的水解酶中,亮氨酸氨基肽酶显著高于β-1, 4-N-乙酰氨基葡萄糖苷酶的活性。从总的趋势看,施用有机肥提高了2种氮转化酶的活性,但仅在30 d和90 d时对β-1, 4-N-乙酰氨基葡萄糖苷酶的活性增加显著;而施用无机肥则降低了2种氮转化酶的活性,在30 d和90 d时对亮氨酸氨基肽酶活性降低达显著水平,且显著低于有机肥处理。说明亮氨酸氨基肽酶对化肥较为敏感,且活性受到抑制;而β-1, 4-N-乙酰氨基葡萄糖苷酶对有机肥较为敏感,且活性得到促进。
参与磷转化的水解酶活性也表现出对不同施肥具有不同的响应特征。与对照相比,施用有机肥在整个培养阶段都降低了磷酸酶的活性,并显著低于无机肥处理;而无机肥处理总体上并未影响磷酸酶的活性(只有中期30 d时,显著低于对照)。
用对数转化后的几何平均数来表示总酶活性。图 1结果显示,施加化肥处理总酶活性在中后期2次采样中都显著低于对照,而有机肥处理总酶活性与对照基本持平,表明有机肥在保持土壤酶活和功能稳定性方面有重要作用。
为明确7类土壤水解酶对不同施肥处理的响应是否有差异,使用经过计算相对比例后的酶数据进行NMDS分析(图 2)。结果显示:NMDS排序的stress值为0.036 5,小于0.1, 表明排序效果良好;相似性检验(ADONIS)的结果说明处理和时间均显著影响土壤水解酶活性(处理:R2=0.533 2***,时间:R2= 0.344 7***)。
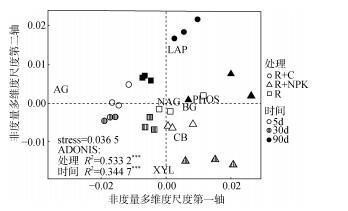
|
(土壤酶活性的非度量多维尺度分析表征经过标准化处理的土壤酶活性数据的距离矩阵。不同形状的符号代表不同处理,不同填充样式代表不同的培养时间) 图 2 土壤酶活性的非度量多维尺度分析(NMDS) Fig. 2 NMDS plot of soil hydrolase activities |
相似性检验(ANOISM)能够比较不同肥料处理之间的差异大小(R2 > 0,表明处理之间存在差异),在5、30和90 d时,R2值在0.72 ~ 0.99间浮动,P值为0.008 ~ 0.014。说明3个培养时间下各施肥处理的水解酶差异显著。同时结合图 2中不同处理点位置的相对远近,处理之间距离越远,酶活性变化的差异越大,且不同处理在图中的位置不同也说明各处理中不同酶的活性变化是不同的。
此外,不同土壤酶在图中的位置是根据加权平均值计算得来,其位置离中心点(0, 0)越远且靠近坐标轴,说明该酶对坐标轴的贡献越大,也说明施肥对其活性的影响越大,例如α-1, 4-葡萄糖苷酶(AG)、亮氨酸氨基肽酶(LAP)和木聚糖酶(XYL)偏离中心点较远,同时各施肥处理在图中的位置与土壤酶的位置越接近说明该酶在相应处理中的值越大。进一步表明不同施肥处理之间的酶活性差异主要来源于AG和LAP的贡献,这与图 1中的结果完全一致(相较于对照处理,有机肥处理的AG和LAP酶活性明显增加,而化肥处理的明显下降)。在图 1中,与对照相比,有机肥处理的磷酸酶活性显著降低,而化肥处理的无变化,这与图 2的结果一致。以上结果说明土壤水解酶对不同施肥处理的响应程度并不一致,这其中α-1, 4-葡萄糖苷酶和亮氨酸氨基肽酶响应最明显,其次为磷酸酶与木聚糖酶。
2.3 土壤酶活性与土壤理化性质的关系相关性分析结果(表 5)显示,土壤总酶活性仅与土壤pH、土壤呼吸有正相关关系。在参与碳转化的4种酶中,α-1, 4-葡萄糖苷酶与土壤pH、土壤呼吸具有显著正相关关系,而与速效氮含量有显著负相关关系;β-葡萄糖苷酶与pH有显著负相关关系,与速效氮为显著正相关关系;纤维素酶与土壤pH、可溶性有机碳有显著负相关关系;木聚糖酶仅与土壤呼吸有显著正相关关系;对于两种参与氮转化的酶来说,亮氨酸氨基肽酶仅与土壤呼吸有显著负相关关系,而β-1, 4-N-乙酰氨基葡萄糖苷酶与可溶性有机碳、有效磷有显著正相关关系;参与磷转化的磷酸酶与速效氮呈显著正相关关系,而与其他土壤理化指标呈显著负相关关系。
|
|
表 5 土壤酶活性与土壤理化性质的相关性分析 Table 5 Correlation analysis between soil hydrolase activities and soil properties |
采用冗余分析方法,进一步揭示不同土壤水解酶活性的相对变化情况与土壤理化性质之间的关系(图 3)。结果显示,前两个限制轴(PC1和PC2)能解释水解酶活性总变异的52.52%。其中第一轴可解释水解酶活性变异的32.26%,以土壤pH、可溶性有机碳、土壤呼吸和速效氮以及α-1, 4-葡萄糖苷酶、β-1, 4-葡萄糖苷酶和磷酸酶对第一轴的贡献最大。第二轴可解释水解酶活性变异的20.26%,且以亮氨酸氨基肽酶、木聚糖酶为主要贡献因子。不同肥料对土壤酶活性及理化性质的影响较大,3个处理分别位于3个象限中。有机肥明显提高土壤可溶性有机碳含量、土壤呼吸强度以及土壤pH;化肥明显提高土壤速效氮含量,降低土壤pH,同时α-1, 4-葡萄糖苷酶、β-1, 4-N-乙酰氨基葡萄糖苷酶和亮氨酸氨基肽酶活性在有机肥处理中提高,在化肥处理中活性降低(图 1,表 3)
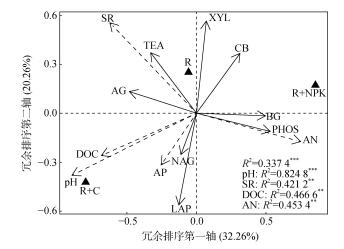
|
(图中实心三角形代表不同的处理,箭头的方向指向变量的方向和量级,实线箭头代表土壤酶的类别,虚线箭头代表土壤理化性质。SR:土壤呼吸;DOC:可溶性有机碳;AN:速效氮;AP:有效磷) 图 3 土壤酶活性与土壤理化性质的冗余排序图 Fig. 3 Redundancy analysis ordination showing relation between soil hydrolase activities and soil physicochemical properties |
在本研究中并不是所有土壤水解酶都对肥料有强烈的响应(表 3)。只有参与碳转化的α-1, 4-葡萄糖苷酶,参与氮转化的亮氨酸氨基肽酶、β-1, 4-N-乙酰氨基葡萄糖苷酶以及参与磷转化的磷酸酶和总酶活性对不同的施肥处理有着显著的响应(表 3,图 1)。以往的研究表明[2-4]:土壤酶活性与土壤速效养分含量存在负反馈调节,即当土壤中速效养分含量升高时,相应的酶活性就降低。
在本研究中,有机肥处理的α-1, 4-葡萄糖苷酶活性在30 d之前增加,这与荣勤雷等[17]研究结果一致,即有机肥或有机肥与化肥配施能提高土壤α-1, 4-葡萄糖苷酶活性,因而并不符合负反馈调节的假设。这可能是因为有机肥提高了土壤环境的pH(R2=0.55**),接近酶促反应的最适pH,同时可能带入一定数量的底物,从而促进了α-1, 4-葡萄糖苷酶活性的提高。但在90 d时有机肥处理的α-1, 4-葡萄糖苷酶活性显著低于对照处理,可能是由于微生物利用α-1, 4-葡萄糖苷酶水解的产物用于自身的生长代谢(添加有机肥的处理土壤呼吸明显提高),底物被大量消耗,没有充足的底物刺激α-1, 4-葡萄糖苷酶,致使其活性下降。此外,化肥的添加明显抑制α-1, 4-葡萄糖苷酶活性,这与前人研究结果不一致[18],可能与试验条件不一致有关,在本试验中该酶活性受土壤pH的影响较其他碳转化酶大。化肥添加改变了土壤环境的pH,偏离了α-1, 4-葡萄糖苷酶的最适pH,因此酶活性降低,同时土壤pH降低使微生物数量减少,对碳源的需求相应减少[19-20]。此外在5 d和30 d时,β-1, 4-葡萄糖苷酶、纤维素酶和木聚糖酶活性对施肥无响应,而在90 d时有一定的下降趋势,说明这3种酶在本试验条件下对肥料添加的响应不敏感,表现出一定的稳定性。相关性分析结果也显示,β-1, 4-葡萄糖苷酶、纤维素酶活性和木聚糖酶活性分别与速效氮、可溶性有机碳和土壤呼吸速率有显著的正相关关系,进一步说明碳氮转化酶复杂的耦联关系
本研究中,对于碳转化酶来说,负反馈调节的假设并不能完全解释土壤酶活性变化。值得注意的是,4种参与碳转化的酶活性范围并不一致:β-1, 4-葡萄糖苷酶活性最大(约200 ~ 400 nmol/(g·h)),其次是纤维素酶活性(约100 ~ 200 nmol/(g·h)),最后是α-1, 4-葡萄糖苷酶和木聚糖酶活性(约25 ~ 125 nmol/(g·h)),一定程度说明β-1, 4-葡萄糖苷酶仍然是参与土壤碳转化的主要酶,即使它对不同肥料添加未有明显的响应,一般情况下,β-1, 4-葡萄糖苷酶由于被土壤胶体保护,所以其活性相对稳定[21]。
亮氨酸氨基肽酶、β-1, 4-N-乙酰氨基葡萄糖苷酶对不同肥料的响应明显不同(图 1)。亮氨酸氨基肽酶可水解蛋白质,能够从多肽的N端水解亮氨酸和其他疏水氨基酸[22]。有机肥处理一定程度上提高了亮氨酸氨基肽酶和β-1, 4-N-乙酰氨基葡萄糖苷酶活性,但与对照相比并没有全部达到显著差异,这可能是因为有机肥能增加酶所作用的底物从而间接提高酶活性[23],但底物在有机肥中的数量可能较低,提高其活性的作用不明显;相反化肥处理的亮氨酸氨基肽酶活性显著降低,可能是由于速效氮含量的显著增加(表 3)抑制了该酶活性,表现出一定的负反馈调节作用。β-1, 4-N-乙酰氨基葡萄糖苷酶用来指示土壤中几丁质物质的降解情况[24],几丁质是土壤中重要的有机氮过渡库[25],研究表明不同生态系统β-1, 4-N-乙酰氨基葡萄糖苷酶活性有千倍之差[5],表现出对不同生态系统的特异性[26]。本研究中化肥与有机肥的添加,一定程度提高了β-1, 4-N-乙酰氨基葡萄糖苷酶活性(5 d、30 d),其活性变化范围远低于亮氨酸氨基肽酶,说明在土壤中亮氨酸氨基肽酶在氮转化过程中起主导作用。此外,有机肥处理的有效磷含量显著提高,对应磷酸酶活性显著下降,表现出一定的负反馈调节现象,添加化肥的处理也有相同的现象,有效磷作为磷酸酶的负反馈调节因子在大多数研究中都较为普遍[4]。
从酶活性结果得知(图 1),与对照相比,有机肥处理在3个采样时间的总酶活性并没有显著变化,同时添加化肥的处理在5 d时总酶活性也没有明显差异。而NMDS分析结果显示(图 2),在5 d时,化肥、对照处理与有机肥处理大致分成两簇出现,并且随培养时间的增加,三者的差异逐渐变大。一定程度上说明化肥相对于有机肥在影响土壤酶活性上存在一定的滞后现象,同时也表明虽然总酶活性无明显变化,但在有机肥处理中,不同酶活性的相对分配随培养时间增加有了明显的响应差异。这一方面可能是由于酶作用的底物数量不断发生变化[27],酶活性与底物浓度一般符合米氏动力学方程,底物浓度的不同影响酶活性的大小;另一方面由于酶的合成耗费大量能量和物质,自然选择使土壤微生物遵循用最少的营养获得最大效益的“成本效益原则”[3],以及遵守一定的化学计量平衡[28]。土壤微生物按照这些原则,根据环境中已有的资源重新分配不同酶的活性,同时不改变总酶活性,来满足微生物自身生长发育对营养的需求。而化肥处理在5 d时总酶活性与对照没有显著差异,随后显著降低,化肥强烈改变土壤pH(表 3),使土壤环境不利于酶的催化反应过程,导致总酶活性的不断降低。
研究表明土壤酶活性受到温度、pH和重金属等因素的影响[2-6]。本研究中土壤pH与α-1, 4-葡萄糖苷酶、β-1, 4-葡萄糖苷酶、纤维素酶、磷酸酶都有显著相关性。磷酸酶与土壤性质均有显著的相关关系。冗余分析中,5个环境因子能够解释酶活性总变异的52.52%,模型拟合度R2=0.337 4***,达到极显著水平,其中土壤pH的贡献最大,土壤pH与可溶性有机碳对土壤酶活性影响最大。说明土壤pH与可溶性有机碳是影响土壤酶活性的关键因子,这与前人的研究结果一致[29]。同时,土壤酶活性对土壤环境的变化响应敏感,使其能较好地指示土壤肥力或土壤健康变化。
4 小结在室内培养没有植物和土壤动物等干扰的条件下,有机肥并没有提高土壤总酶活性,而化肥则明显降低土壤总酶活性,这一定程度表明有机肥在保持土壤功能稳定和健康方面有重要作用。由于土壤养分状况不同以及土壤微生物的反馈,参与土壤碳氮磷水解酶活性对施肥的响应产生分异,α-1, 4-葡萄糖苷酶和亮氨酸氨基肽酶响应最明显,其次为磷酸酶与木聚糖酶。
| [1] |
Grandy A S, Neff J C, Weintraub M N. Carbon structure and enzyme activities in alpine and forest ecosystems[J]. Soil Biology and Biochemistry, 2007, 39(11): 2701-2711 DOI:10.1016/j.soilbio.2007.05.009 (  0) 0) |
| [2] |
Burns R G, DeForest J L, Marxsen J, et al. Soil enzymes in a changing environment: Current knowledge and future directions[J]. Soil Biology and Biochemistry, 2013, 58: 216-234 DOI:10.1016/j.soilbio.2012.11.009 (  0) 0) |
| [3] |
Allison S D, Weintraub M N, Gartner T B, et al. Evolutionary-economic principles as regulators of soil enzyme production and ecosystem function[J]. Soil Enzymology, 2011 (  0) 0) |
| [4] |
Luo L, Meng H, Gu J D. Microbial extracellular enzymes in biogeochemical cycling of ecosystems[J]. Journal of Environmental Management, 2017, 197: 539-549 DOI:10.1016/j.jenvman.2017.04.023 (  0) 0) |
| [5] |
Sinsabaugh R L, Lauber C L, Weintraub M N, et al. Stoichiometry of soil enzyme activity at global scale[J]. Ecology Letters, 2008, 11(11): 1252-1264 DOI:10.1111/j.1461-0248.2008.01245.x (  0) 0) |
| [6] |
Lazcano C, Gómez-Brandón M, Revilla P, et al. Short-term effects of organic and inorganic fertilizers on soil microbial community structure and function[J]. Biology and Fertility of Soils, 2013, 49(6): 723-733 DOI:10.1007/s00374-012-0761-7 (  0) 0) |
| [7] |
Moeskops B, Sukristiyonubowo, Buchan D, et al. Soil microbial communities and activities under intensive organic and conventional vegetable farming in West Java, Indonesia[J]. Applied Soil Ecology, 2010, 45(2): 112-120 DOI:10.1016/j.apsoil.2010.03.005 (  0) 0) |
| [8] |
宋震震, 李絮花, 李娟, 等. 有机肥和化肥长期施用对土壤活性有机氮组分及酶活性的影响[J]. 植物营养与肥料学报, 2014, 20(3): 525-533 (  0) 0) |
| [9] |
田善义, 王明伟, 成艳红, 等. 化肥和有机肥长期施用对红壤酶活性的影响[J]. 生态学报, 2017, 37(15): 4963-4972 (  0) 0) |
| [10] |
Sinsabaugh R L, Moorhead D L. Resource allocation to extracellular enzyme production: a model for nitrogen and phosphorus control of litter decomposition[J]. Soil Biology & Biochemistry, 1994, 26(10): 1305-1311 (  0) 0) |
| [11] |
孔爱辉, 吴京科. 我国土壤水解酶活性研究进展[J]. 现代农业科技, 2012(16): 251-253, 260 (  0) 0) |
| [12] |
Schnecker J, Wild B, Takriti M, et al. Microbial community composition shapes enzyme patterns in topsoil and subsoil horizons along a latitudinal transect in Western Siberia[J]. Soil Biology and Biochemistry, 2015, 83: 106-115 DOI:10.1016/j.soilbio.2015.01.016 (  0) 0) |
| [13] |
鲁如坤. 土壤农业化学分析方法[M].
中国农业科技出版社, 北京, 2000
(  0) 0) |
| [14] |
Bell C W, Fricks B E, Rocca J D, et al. High-throughput fluorometric measurement of potential soil extracellular enzyme activities[J]. Journal of Visualized Experiments, 2013(81): e50961 (  0) 0) |
| [15] |
范淼珍, 尹昌, 范分良, 等. 长期不同施肥对红壤碳、氮、磷循环相关酶活性的影响[J]. .应用生态学报, 2015, 26(3): 833-838 (  0) 0) |
| [16] |
和文祥, 谭向平, 王旭东, 等. 土壤总体酶活性指标的初步研究[J]. 土壤学报, 2010, 47(6): 1232-1236 (  0) 0) |
| [17] |
荣勤雷, 梁国庆, 周卫, 等. 不同有机肥对黄泥田土壤培肥效果及土壤酶活性的影响[J]. 植物营养与肥料学报, 2014, 20(5): 1168-1177 (  0) 0) |
| [18] |
陆海飞, 郑金伟, 余喜初, 等. 长期无机有机肥配施对红壤性水稻土微生物群落多样性及酶活性的影响[J]. 植物营养与肥料学报, 2015, 21(3): 632-643 (  0) 0) |
| [19] |
Rousk J, B th E, Brookes P C, et al. Soil bacterial and fungal communities across a pH gradient in an arable soil[J]. The ISME Journal, 2010, 4(10): 1340-1351 DOI:10.1038/ismej.2010.58 (  0) 0) |
| [20] |
Zeng J, Liu X J, Song L, et al. Nitrogen fertilization directly affects soil bacterial diversity and indirectly affects bacterial community composition[J]. Soil Biology and Biochemistry, 2016, 92: 41-49 DOI:10.1038/ismej.2010.58 (  0) 0) |
| [21] |
Moscatelli M C, Lagomarsino A, Garzillo A M Ⅴ, et al. Β-Glucosidase kinetic parameters as indicators of soil quality under conventional and organic cropping systems applying two analytical approaches[J]. Ecological Indicators, 2012, 13(1): 322-327 DOI:10.1016/j.soilbio.2015.09.018 (  0) 0) |
| [22] |
何翠翠.长期不同施肥措施对黑土土壤碳库及其酶活性的影响研究[D].北京: 中国农业科学院, 2014.
(  0) 0) |
| [23] |
German D P, Weintraub M N, Grandy A S, et al. Optimization of hydrolytic and oxidative enzyme methods for ecosystem studies[J]. Soil Biology and Biochemistry, 2011, 43(7): 1387-1397 DOI:10.1016/j.soilbio.2011.03.017 (  0) 0) |
| [24] |
Stone M M, Deforest J L, Plante A F. Changes in extracellular enzyme activity and microbial community structure with soil depth at the Luquillo Critical Zone Observatory[J]. Soil Biology & Biochemistry, 2014, 75: 237-247 (  0) 0) |
| [26] |
张威, 张明, 白震, 等. 土壤中几丁质酶的研究进展[J]. 土壤通报, 2007, 38(3): 569-575 (  0) 0) |
| [27] |
Koyama A, Wallenstein M D, Simpson R T, et al. Carbon-degrading enzyme activities stimulated by increased nutrient availability in Arctic tundra soils[J]. PLoS One, 2013, 8(10): e77212 DOI:10.1371/journal.pone.0077212 (  0) 0) |
| [30] |
王理德, 王方琳, 郭春秀, 等. 土壤酶学硏究进展[J]. 土壤, 2016, 48(1): 12-21 (  0) 0) |
| [28] |
Cleveland C C, Liptzin D. C: N: P stoichiometry in soil: is there a "Redfield ratio" for the microbial biomass?[J]. Biogeochemistry, 2007, 85(3): 235-252 DOI:10.1007/s10533-007-9132-0 (  0) 0) |
| [29] |
袁颖红, 张文锋, 周际海, 等. 改良剂对旱地红壤活性有机碳及土壤酶活性的影响[J]. 土壤, 2017, 49(5): 909-918 (  0) 0) |
 2020, Vol. 52
2020, Vol. 52


