2. 封丘农田生态系统国家实验站, 土壤与农业可持续发展国家重点实验室(中国科学院南京土壤研究所), 南京 210008
秸秆中富含有机碳(C)和氮(N)、磷(P)、钾(K)等营养元素,是一种重要的有机肥源。据统计,2015年我国小麦、玉米、水稻秸秆资源总量达7.2亿t,占秸秆总量的86.4%,其中含有的碳、氮、磷、钾分别为2.68亿t、625.6万t、197.9万t、1 159.5万t[1]。秸秆还田后,C和营养元素均随着秸秆在土壤中的降解而不断释放,残留在土壤中的碳、氮、磷、钾成为土壤肥力的重要组成[2],同时也有可能影响其中的微生物群落组成。
微生物是秸秆分解过程中的主要推动者,其在秸秆上的数量和群落组成主要受秸秆的化学组成、土壤性质等诸多因素的影响[3]。一方面,微生物能够分解、吸收秸秆中的养分物质用于自身生长,从而促进秸秆的分解;另一方面,随着秸秆的分解,其所含的有机碳和营养元素被逐渐释放,营养条件的变化也会导致分解秸秆的微生物群落结构发生变化[4]。Marschner等[5]试验表明,秸秆中的养分含量显著影响微生物的群落结构;而在不同类型土壤间,土壤的理化性质和微生物的遗传背景也有所不同,这也会导致秸秆的分解和微生物群落的演变有一定差异[6];仇存璞等[7]研究表明,在秸秆分解过程中,秸秆性质和土壤条件的不同是导致微生物群落不同的主要原因。
黄淮海平原是我国重要的粮食产区之一,潮土为耕作区中的主要土壤类型,受黄泛区沉积物近砂远淤规律的影响,土壤质地有所不同[8]。为探索分解秸秆的微生物在不同秸秆类型和土壤质地间的差异,本研究采用尼龙网袋法,以小麦和玉米秸秆为研究对象,以黄淮海平原典型的砂质、壤质、黏质潮土为秸秆分解媒介,其主要研究目的包括:①明确小麦和玉米秸秆在3种质地潮土上的分解行为和残留秸秆中养分含量及基于磷脂脂肪酸(PLFA)技术的微生物群落组成,②探究残留秸秆养分和微生物群落组成之间的关系,③评价秸秆类型和潮土质地对上述关系的影响。
1 材料与方法 1.1 供试土壤本试验始于2012年10月的小麦季,在河南省封丘县潘店乡的中国科学院封丘农业生态实验站(35°01′N,114°24′E)的“土壤地力提升长期田间试验平台”进行。该试验平台有砂质、壤质、黏质3种质地潮土,分别采自封丘县黄陵镇(34°58′N,114°42′E)、潘店镇(35°01′N,114°34′E)、黄德镇(35°11′N,114°25′E)。在本次试验开始前,试验地为已经经过5 a没有进行任何试验的匀地,采取与当地农户相同的作物种植和管理方式。试验开始前的土壤基本理化性质见表 1。
|
|
表 1 3种质地土壤的基本理化性质 Table 1 Basic physiochemical properties of three tested soils |
小麦和玉米秸秆80℃烘干后,各取15.0 g(< 5 mm)分别放入200目的双层尼龙网袋(14.0 cm×12.5 cm),将网袋用封口机密封。将封口的尼龙网袋于2012年12月10日(小麦苗期)埋设于小麦行间,埋设深度为20 cm,各质地土壤中均埋设3个小麦和玉米秸秆网袋。试验地采用与当地相同的冬小麦-夏玉米轮作模式。小麦和玉米秸秆的起始养分含量见表 2。
|
|
表 2 秸秆起始养分含量 Table 2 Initial nutrient contents in wheat and maize straws |
试验样品采集于2013年10月10日(玉米收获期,即秸秆经过约10个月分解),将网袋取出后放于保温箱内带回试验室。网袋内样品称重后,一部分于60℃烘干测定其含水量,粉碎机磨碎后测定其C、N、P、K含量;另一部分存于-20 ℃冰箱中保存用于测定磷脂脂肪酸(PLFA)含量。
1.3 样品分析方法秸秆分解率采用差重法测量,计算公式为:
| $ \begin{array}{l} 秸秆分解率 \left( \% \right) = \\ \frac{{起始秸秆干重 - 残余秸秆干重 }}{起始秸秆干重 } \times 100 \end{array} $ | (1) |
秸秆碳含量采用重铬酸钾-外加热法测定[9];秸秆养分含量采用H2SO4-H2O2消煮法制备待测液,用凯氏定氮法测定全氮含量,钼锑抗比色法测定全磷含量,火焰光度法测定全钾含量[10]。
秸秆碳或养分残留率的计算公式为:
| $ \begin{array}{l} 秸秆碳(养分)残留率 \left( \% \right) = \\ \frac{{残余秸秆干重 \times 残余秸秆碳(养分)含量 }}{{起始秸秆干重 \times 起始秸秆碳(养分)含量 }} \times 100 \end{array} $ | (2) |
秸秆中微生物群落结构采用PLFA法测定,提取方法采用修正的Bligh-Dyer法[11]。参考前人研究,将微生物分为细菌、真菌、放线菌3类[12],具体分类标准见表 3。
|
|
表 3 表征土壤微生物类型的特征磷脂脂肪酸 Table 3 Characteristic PLFAs expressing soil microbial types |
试验数据采用Microsoft Excel 16.0、IBM Statistics SPSS 24.0、Origin 2017和Canoco 4.5软件进行数理统计和作图,数据分析采用双因素方差分析,多重比较采用最小显著法(LSD)进行显著性检验(P < 0.05)。
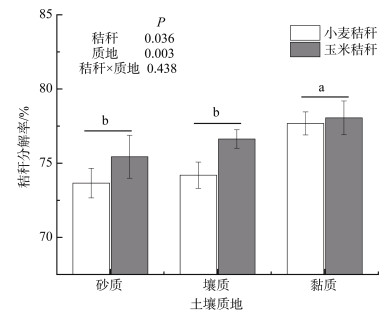
2 结果与讨论 2.1 秸秆分解率及其中碳和养分残留率经10个月分解后,秸秆类型和土壤质地均显著影响秸秆分解率(图 1)。小麦秸秆的平均分解率(75.18%)显著低于玉米秸秆(76.71%)(P < 0.05),在砂土和壤土中表现尤为明显。随土壤质地变黏重,秸秆分解率显著增大,两种秸秆在黏土中的平均分解率(77.87%)比壤土(75.41%)和砂土(74.55%)分别高3.26% 和4.45%(P < 0.05),而壤土和砂土中的秸秆分解率无显著差异。
|
(图中数据为平均值,误差线为标准误,不同小写字母代表不同质地土壤中差异在P < 0.05水平显著,下同) 图 1 小麦玉米秸秆分解率 Fig. 1 Decomposition rates of wheat and maize straws |
玉米秸秆的分解率高于小麦秸秆的原因可能是:①小麦秸秆中含有较多难分解的纤维素和木质素,而玉米秸秆中含有更多易分解的水溶性物质和粗蛋白质,这可能是造成玉米秸秆分解速度更快的重要原因之一[13];②玉米秸秆的初始C/P比低于小麦秸秆(表 2),低C/P比也能够促进玉米秸秆的分解[14]。不同质地土壤中秸秆分解率的差异表明,土壤质地能够显著影响秸秆的分解。李新举等[15]研究发现,随土壤黏粒数量的增多,秸秆分解速度会加快;刘四义等[16]研究表明,微生物对秸秆的分解受到土壤中养分含量的影响。本研究中黏质土壤较砂质土壤含有更多的氮素(表 1),从而能够缓解对秸秆分解的养分限制,这可能是造成黏质土壤中秸秆分解更快的原因之一。
由表 4可知,秸秆类型对秸秆中碳和氮的残留率无显著影响,小麦和玉米秸秆的平均碳残留率分别为22.17% 和21.13%,平均氮残留率分别为40.09% 和42.72%;秸秆碳残留率随着土壤质地变黏重而显著降低,而氮残留率不受土壤质地影响。秸秆类型和土壤质地均显著影响秸秆中磷的释放,小麦秸秆磷的平均残留率显著高于玉米秸秆,砂土中小麦和玉米秸秆磷残留率分别比壤土、黏土中低20.24%、20.44% 和14.38%、21.78%。小麦秸秆的钾残留率显著低于玉米秸秆,但不受土壤质地影响。
|
|
表 4 秸秆在不同质地土壤中分解10个月后的碳和养分残留率(%) Table 4 Residual rates of carbon and nutrients of wheat and maize straws decomposed for 10 months in soils of different textures |
小麦和玉米秸秆养分残留率的差异可能与初始小麦秸秆较低的磷含量以及较高的钾含量有关(表 2)。不同质地土壤中秸秆碳和磷残留率的不同,表明土壤质地能够影响秸秆养分的释放。匡恩俊等[17]研究表明,在秸秆分解过程中,碳是随秸秆分解逐渐释放的,即分解率越大,碳残留率越低,与本试验结果相同。砂质土壤中秸秆磷残留率显著小于壤质和黏质土壤中,这可能与质地间不同的土壤结构有关。有研究表明,随土壤中黏粒含量的增加,土壤养分的淋溶损失风险越来越小,砂质土壤相比壤质、黏质土壤,养分更易淋失[18]。
2.2 残留秸秆养分含量和微生物群落组成 2.2.1 残留秸秆养分含量由表 5可知,秸秆分解10个月后,小麦和玉米残留秸秆的碳含量无显著差异,而小麦残留秸秆的平均氮(17.41 g/kg)、磷(0.82 g/kg)、钾(0.71 g/kg)含量分别比玉米残留秸秆氮(19.78 g/kg)、磷(1.26 g/kg)、钾含量(0.85 g/kg)低11.99%、34.35%、16.73%(P < 0.05);在各质地土壤中,残留秸秆碳和氮、钾含量无显著性差异,磷含量随土壤质地变黏重而显著增大,砂土中小麦和玉米残留秸秆磷含量分别比壤土、黏土中低21.83%、32.06% 和18.61%、20.61%;小麦和玉米残留秸秆的氮、磷平均含量较原始秸秆(表 2)分别增加61.67%、42.15% 和85.93%、30.83%(P < 0.05),而碳、钾含量分别降低10.06%、96.69% 和17.01%、92.85%(P < 0.05)。
|
|
表 5 秸秆在不同质地土壤中分解10个月后的碳和养分含量(g/kg) Table 5 Carbon and nutrient contents in wheat and maize straws decomposed for 10 months in soils of different textures |
王晓玥等[19]研究发现,秸秆氮含量在秸秆分解过程中是逐渐增加的,与本试验结果一致。秸秆氮含量增加的原因可能有以下两点:①秸秆自身氮素的存在状态,作物秸秆中的氮主要分为易分解的贮存性氮素(如硝态、铵态、小分子有机氮等)和难分解的结构性氮素(如植物叶绿素、蛋白质、酶等),随着秸秆分解过程的进行,结构性氮的积累造成秸秆氮含量相对增加[20];②微生物的固氮效应,秸秆中的微生物通过吸收利用秸秆和土壤中的无机氮,将其转化为有机氮,从而减少氮素淋失。玉米秸秆较高的氮含量可能与玉米秸秆上更多的真菌和放线菌有关(表 6),这两种微生物能够通过菌丝吸收土壤中的无机氮,从而将土壤中的氮转移到秸秆上[21]。研究表明,秸秆中磷的矿化速率小于秸秆分解速率,秸秆中磷含量会随秸秆的分解而增大[22],这也是随土壤质地变黏重,秸秆磷含量增加的原因;玉米残留秸秆中较高的磷含量可能与玉米秸秆的初始磷含量较高有关(表 2)。钾元素的大量释放与其存在形态有关,钾在作物体内主要以易溶于水的离子态形式存在,因此在秸秆分解过程中能够快速释放出来[20]。小麦和玉米秸秆中钾含量的差异可能与不同类型秸秆中其他形态钾的含量有关。
|
|
表 6 秸秆在不同质地土壤中分解10个月后的PLFA含量(μg/g) Table 6 PLFA contents of wheat and maize straws decomposed for 10 months in soils of different textures |
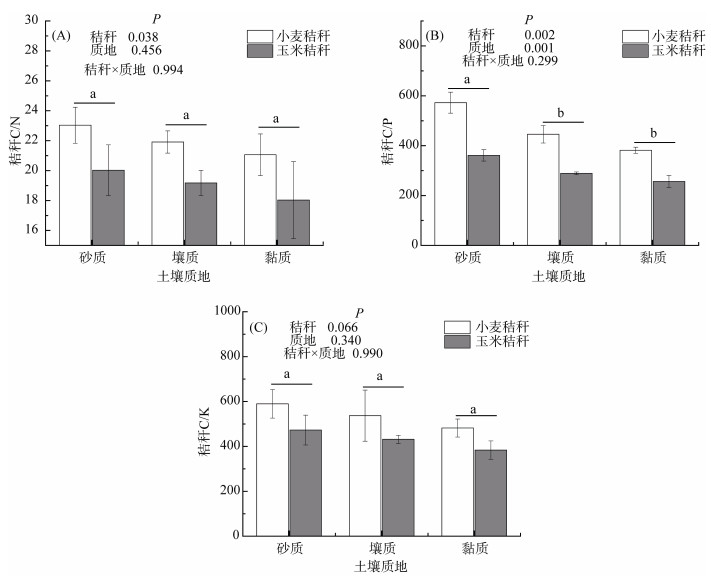
进一步计算的养分比值结果(图 2)表明,秸秆分解10个月后,在各质地土壤中,随土壤质地由砂到黏,秸秆C/N、C/P、C/K呈降低趋势,其中C/P差异性显著;小麦残留秸秆平均C/N(22.00)、C/P (466.62)、C/K(536.53)分别比玉米秸秆C/N(19.08)、C/P(302.29)、C/K(429.49)高15.33%、54.36%、24.92%,但C/K差异性不显著;小麦和玉米残留秸秆C/N、C/P较原始秸秆分别降低42.65%、34.50%和54.93%、35.57%(P < 0.05),而C/K从原始的19.23和37.75显著增大到536.53和429.49。
|
图 2 不同质地土壤中分解10个月后秸秆的C/N(A)、C/P(B)、C/K(C) Fig. 2 C/N (A), C/P (B), C/K (C) of wheat and maize straws decomposed for 10 months in soils of different textures |
刘世平等[23]研究表明,在秸秆分解过程中,碳损失要大于氮损失,导致残留秸秆的C/N比逐渐降低(图 2A),而磷、钾在秸秆分解前期释放较快,后期释放缓慢,因此C/P、C/K比具有先快速增大,后缓慢降低的特征,这也是随土壤质地由砂到黏,秸秆分解率逐渐增大,C/N、C/P、C/K比逐渐减小的原因(图 2B、2C)。
2.2.2 PLFA含量由表 6可知,分解10月后,秸秆类型和土壤质地显著影响了残留秸秆中G+和G-的含量,而小麦和玉米残留秸秆中的细菌、真菌、放线菌和总PLFA含量无显著性差异;随土壤质地由砂到黏,残留秸秆中细菌、真菌、总PLFA含量显著降低,放线菌含量显著升高,砂质土壤中残留秸秆的细菌(166.15 μg/g)、真菌(39.33 μg/g)、总PLFA(211.25 μg/g)平均含量比壤质土壤中(137.84、31.18、177.88 μg/g)和黏质土壤中(124.50、27.36、163.04 μg/g)高20.54%、26.15%、18.76% 和33.45%、43.74%、29.57%(P < 0.05),而砂质土壤中残留秸秆放线菌含量(5.8 μg/g)比壤质(8.7 μg/g)、黏质(11.2 μg/g)土壤中低34.89%、48.36%(P < 0.05)。
秸秆中所含的矿质元素、有机质等微生物所必需的养分,能促进微生物的生长繁殖,微生物数量的增加也能促进秸秆分解。随秸秆的分解,其养分含量和配比不断变化,微生物的群落结构也随之改变。PLFA是活体生物细胞膜上的一种重要成分,不同类群微生物的标志性PLFA不同,因此,可以通过提取、测定秸秆中PLFA的种类和数量来分析微生物的群落结构和营养状况[24]。
残留秸秆中G+和G-含量的不同说明秸秆类型和土壤质地均能显著影响秸秆中细菌的群落组成,这与仇存璞等[7]的研究结果类似。不同质地土壤中秸秆细菌、真菌和总PLFA含量的不同,表明土壤质地能够影响秸秆中的微生物数量,这与Girvan等[25]的研究结果类似。不同质地土壤中秸秆微生物含量的差异可能与以下因素有关:①含水量不同,有研究表明土壤水分较少时,细菌的活性更强,数量更多[26],砂土的持水性弱于壤土和黏土,土壤含水量的差异可能是引起细菌含量不同的原因之一;②通气条件不同,邢肖毅等[27]研究表明,充足的氧气能够增加土壤中微生物数量,砂土良好的通气性有利于微生物的生长繁殖;③秸秆分解程度不同,一方面,随着秸秆的不断分解,秸秆能够为微生物提供的碳和养分减少,导致微生物群落的生长逐渐减缓乃至消亡[28],韩錦泽等[29]也发现随着秸秆的不断分解,土壤和秸秆中的微生物含量逐渐降低;另一方面,有研究表明,在秸秆分解后期,残留秸秆中复杂化合物的分解并不是由微生物驱动的,碳源代谢的微生物数量会随秸秆分解逐渐降低[19]。先前研究表明[30],在植物残体分解中后期,放线菌的活动会逐渐加强,放线菌的数量与植物残体分解程度有显著相关性,即植物残体分解率越大,其放线菌含量越高。另外,砂土中秸秆的磷含量显著低于壤土和黏土中(表 5),磷可能对放线菌含量的增加起到了积极作用[31]。
微生物的PLFA能够反映秸秆中微生物的种类和数量,而PLFA的比值能够表征微生物的生存状态和营养状况。由表 7可知,秸秆分解10个月后,秸秆类型显著影响了G+/G-、真菌/细菌、单不饱和脂肪酸/饱和支链脂肪酸的比值,小麦秸秆的G+/G-和真菌/细菌的平均比值分别比玉米秸秆低32.04% 和20.21%(P < 0.05),而单不饱和脂肪酸/饱和支链脂肪酸比值平均比玉米秸秆高23.97%(P < 0.05);土壤质地对G+/G-、真菌/细菌比值的影响不显著,但随土壤质地变黏重,单不饱和脂肪酸/饱和支链脂肪酸比值显著降低,砂质土壤中单不饱和脂肪酸/饱和支链脂肪酸比值分别比壤质和黏质土壤中高5.32% 和19.61% (P < 0.05)。
|
|
表 7 秸秆在不同质地土壤中分解10个月后的PLFA比值 Table 7 PLFA ratios of wheat and maize straws decomposed for 10 months in soils of different textures |
研究发现,G+较G-养分吸收能力更强,更能适应恶劣环境,其比值能反映底物的养分供应能力,底物养分越少,G+/G-比越大,对微生物的营养胁迫越大;真菌/细菌比值能够反映两个种群的相对丰度和生态系统的稳定性,其比值越高说明生态系统的缓冲性和抗干扰能力越强;单不饱和脂肪酸/饱和支链脂肪酸比值越高,表示土壤的通气性越好,微生物所受的氧气胁迫越小[32]。玉米秸秆中G+/G-、真菌/细菌比值大于小麦秸秆,而单不饱和脂肪酸/饱和支链脂肪酸比值小于小麦秸秆,说明玉米秸秆中的微生物受到的胁迫作用可能大于小麦秸秆,但玉米秸秆中PLFA含量并没有低于小麦秸秆,进一步说明小麦和玉米秸秆中微生物群落组成是不同的。Kunito等[33]研究发现,秸秆类型能够显著影响秸秆中微生物群落结构,这可能与秸秆自身的性质有关。研究表明微生物的活性和数量会随胁迫程度的增加而逐渐降低,黏质土壤中秸秆较低的单不饱和脂肪酸/饱和支链脂肪酸比值说明黏质土壤秸秆中的微生物受到的氧气胁迫作用更强[34],这可能是黏质土壤中秸秆PLFA含量较低的原因之一。
2.2.3 冗余分析选取秸秆分解率、秸秆碳、氮、磷、钾含量及C/N、C/P、C/K比作为主要环境因子,对秸秆中微生物群落进行冗余分析(RDA),结果显示,8个环境因子共同解释了92.7% 的微生物群落组成的变异,其中RDA1和RDA2分别解释了微生物群落86.0% 和6.7% 的变异(图 3)。由图 3A可知,小麦秸秆和玉米秸秆的微生物群落组成沿RDA1轴分开,砂质土壤处理与黏质、壤质土壤沿RDA2轴分开,说明秸秆类型和土壤质地均影响了秸秆中微生物的群落结构。小麦秸秆的微生物群落主要受到秸秆中C/N、C/P、C/K比影响,而玉米秸秆的微生物群落主要与秸秆的氮、磷、钾含量和分解率有关,说明残留秸秆的养分状况不同导致了小麦和玉米秸秆中微生物群落结构的差异。
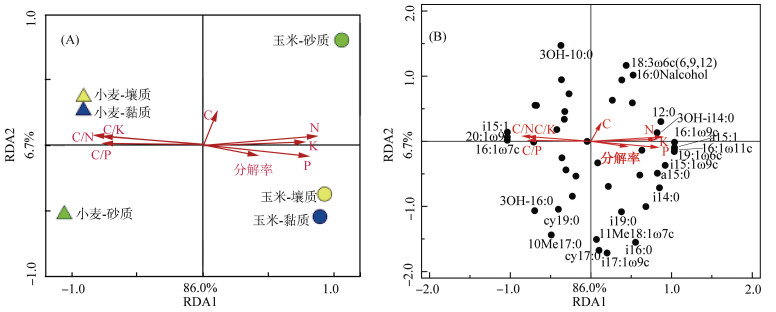
|
图 3 分解10个月后秸秆中微生物群落冗余分析 Fig. 3 Redundancy analysis of microbial communities in wheat and maize straws decomposed for 10 months |
进一步分析可知(图 3B),PLFA 12:0、3OH-i14:0、i14:0、a15:0、i15:1、a15:1、i15:1ω9c、16:1ω7c、16:1ω9c、16:1ω11c、19:1ω6c和20:1ω9c在RDA1轴上得分值较高,也就是说秸秆类型主要影响了这些PLFA所代表的微生物,造成了微生物群落在小麦和玉米秸秆上的分异。这些微生物主要属于G+和G-,研究表明养分条件的变化能显著改变G+和G-的数量[35],本研究中残留玉米秸秆的N、P、K含量显著高于小麦秸秆(表 5),这可能是造成小麦和玉米秸秆中G+和G-含量差异的主要原因。而PLFA i16:0、i17:1ω9c、i19:0、3OH-10:0、3OH-16:0、16:0Nalcohol、cy17:0、cy19:0、18:3ω6c(6, 9, 12)、10Me17:0、11Me18:1ω7c在RDA2轴上得分值较高,说明土壤质地主要影响了这些PLFA所代表的微生物,造成了微生物群落在质地间的分异。Neilson等[36]研究表明,环境条件的改变能显著影响微生物的群落组成,本研究不同质地间土壤性质的不同以及所造成的残留秸秆性质的差异均会引起不同质地土壤中秸秆微生物群落结构的差异,其中秸秆类型的RDA得分(86.0%)显著大于土壤质地的得分(6.7%),说明影响秸秆微生物群落组成的主要因素是秸秆类型。
3 结论小麦和玉米秸秆在砂质、壤质、黏质3种典型潮土上经10个月分解后,随土壤质地变黏重,秸秆分解程度逐渐增大,小麦秸秆分解率小于玉米秸秆;秸秆碳的残留主要受土壤质地影响,秸秆钾的残留主要受秸秆类型影响,秸秆磷的残留受土壤质地和秸秆类型共同影响;残留小麦和玉米秸秆中的养分含量是不同的,不同质地土壤中残留秸秆的养分含量也有差异;随着土壤质地变黏重,秸秆中细菌、真菌、总PLFA含量呈降低趋势,而放线菌含量呈增加趋势;RDA分析表明,不同秸秆类型和不同土壤质地间的微生物群落均有所差异,其中秸秆类型是影响秸秆微生物群落的主要因素。综上所述,小麦和玉米秸秆在3种质地潮土中分解10个月后,秸秆类型和土壤质地均影响了秸秆的分解,残留秸秆养分条件的差异是导致其中微生物数量和群落组成不同的主要原因。
| [1] |
宋大利, 侯胜鹏, 王秀斌, 等. 中国秸秆养分资源数量及替代化肥潜力[J]. 植物营养与肥料学报, 2018, 24(1): 1-21 (  0) 0) |
| [2] |
李金彪, 刘广明, 陈金林, 等. 不同物料掺拌对滨海重度盐土的改良效果研究[J]. 土壤通报, 2017, 48(6): 1481-1485 (  0) 0) |
| [3] |
王宁, 于建光, 常志州, 等. 稻田土壤真菌群落多样性和组成对麦秸还田的响应[J]. 土壤, 2017, 49(6): 1115-1120 (  0) 0) |
| [4] |
王晓玥, 孙波. 植物残体分解过程中微生物群落变化影响因素研究进展[J]. 土壤, 2012, 44(3): 353-359 (  0) 0) |
| [5] |
Marschner P, Kandeler E, Marschner B. Structure and function of the soil microbial community in a long-term fertilizer experiment[J]. Soil Biology & Biochemistry, 2003, 35(3): 453-461 (  0) 0) |
| [6] |
Henriksen T M, Breland T A. Carbon mineralization, fungal and bacterial growth, and enzyme activities as affected by contact between crop residues and soil[J]. Biology and Fertility of Soils, 2002, 35(1): 41-48 DOI:10.1007/s00374-001-0438-0 (  0) 0) |
| [7] |
仇存璞, 陈晓芬, 刘明, 等. 两种典型水稻土中秸秆碳转化的微生物过程[J]. 中国农业科学, 2019, 52(13): 2268-2279 (  0) 0) |
| [8] |
徐基胜, 赵炳梓, 张佳宝. 长期施有机肥和化肥对潮土胡敏酸结构特征的影响[J]. 土壤学报, 2017, 54(3): 647-656 (  0) 0) |
| [9] |
中国土壤学会农业化学专业委员会. 土壤农业化学常规分析方法[M].
科学出版社, 北京, 1983
(  0) 0) |
| [10] |
鲁如坤. 土壤农业化学分析方法[M].
中国农业科技出版社, 北京, 2000
(  0) 0) |
| [11] |
Bardgett R D, Hobbs P J, Frostegård Å. Changes in soil fungal: bacterial biomass ratios following reductions in the intensity of management of an upland grassland[J]. Biology and Fertility of Soils, 1996, 22(3): 261-264 DOI:10.1007/BF00382522 (  0) 0) |
| [12] |
Priha O, Grayston S J, Pennanen T, et al. Microbial activities related to C and N cycling and microbial community structure in the rhizospheres of Pinus sylvestris, Picea abies and Betula pendula seedlings in an organic and mineral soil[J]. FEMS Microbiology Ecology, 1999, 30(2): 187-199 DOI:10.1111/j.1574-6941.1999.tb00647.x (  0) 0) |
| [13] |
郑德明, 姜益娟, 吕双庆, 等. 干旱地区有机肥料腐解及腐殖化系数的研究[J]. 土壤肥料, 2004(2): 15-19 (  0) 0) |
| [14] |
倪雪, 张焕朝, 杨秀莲, 等. 覆盖物对土壤性质及微生物生物量碳氮的影响[J]. 南京林业大学学报(自然科学版), 2017, 41(1): 89-95 (  0) 0) |
| [15] |
李新举, 张志国, 李贻学. 土壤深度对还田秸秆腐解速度的影响[J]. 土壤学报, 2001, 38(1): 135-138 (  0) 0) |
| [16] |
刘四义, 梁爱珍, 杨学明, 等. 不同部位玉米秸秆对两种质地黑土CO2排放和微生物量的影响[J]. 环境科学, 2015, 36(7): 2686-2694 (  0) 0) |
| [17] |
匡恩俊, 迟凤琴, 宿庆瑞, 等. 不同还田方式下玉米秸秆腐解规律的研究[J]. 玉米科学, 2012, 20(2): 99-101, 106 (  0) 0) |
| [18] |
纪雄辉. 洞庭湖区典型稻田土壤养分流失规律及流域模拟研究[D]. 长沙: 湖南农业大学, 2007.
(  0) 0) |
| [19] |
王晓玥, 蒋瑀霁, 隋跃宇, 等. 田间条件下小麦和玉米秸秆腐解过程中微生物群落的变化——BIOLOG分析[J]. 土壤学报, 2012, 49(5): 1003-1011 (  0) 0) |
| [20] |
李昌明, 王晓玥, 孙波. 不同气候和土壤条件下秸秆腐解过程中养分的释放特征及其影响因素[J]. 土壤学报, 2017, 54(5): 1206-1217 (  0) 0) |
| [21] |
陈玲, 范会, 蒋静艳. 不同生态系统土壤生化特征及其与土壤呼吸和N2O排放的关系[J]. 环境科学, 2014, 35(8): 3102-3109 (  0) 0) |
| [22] |
孟祥天, 蒋瑀霁, 王晓玥, 等. 生物质炭和秸秆长期还田对红壤团聚体和有机碳的影响[J]. 土壤, 2018, 50(2): 326-332 (  0) 0) |
| [23] |
刘世平, 陈文林, 聂新涛, 等. 麦稻两熟地区不同埋深对还田秸秆腐解进程的影响[J]. 植物营养与肥料学报, 2007, 13(6): 1049-1053 (  0) 0) |
| [24] |
马玉颖, 张焕朝, 项兴佳, 等. 长期施肥对砂姜黑土丛枝菌根真菌群落的影响[J]. 应用生态学报, 2018, 29(10): 3398-3406 (  0) 0) |
| [25] |
Girvan M S, Bullimore J, Pretty J N, et al. Soil type is the primary determinant of the composition of the total and active bacterial communities in arable soils[J]. Applied and Environmental Microbiology, 2003, 69(3): 1800-1809 (  0) 0) |
| [26] |
马春梅, 唐远征, 季尚宁. 作物定位轮作体系长期试验研究——土壤微生物在作物可生育期间的数量变化(Ⅰ)[J]. 东北农业大学学报, 2004, 35(2): 135-139 (  0) 0) |
| [27] |
邢肖毅, 黄懿梅, 安韶山, 等. 黄土丘陵区不同植被土壤氮素转化微生物生理群特征及差异[J]. 生态学报, 2013, 33(18): 5608-5614 (  0) 0) |
| [28] |
严海元, 辜夕容, 申鸿. 森林凋落物的微生物分解[J]. 生态学杂志, 2010, 29(9): 1827-1835 (  0) 0) |
| [29] |
韩錦泽, 匡恩俊, 迟凤琴, 等. 秸秆深还田对土壤微生物特征及其影响因素的研究[J]. 土壤通报, 2016, 47(5): 1154-1161 (  0) 0) |
| [30] |
郑鸿元, 李凤珍, 卢跃波, 等. 长白山北坡阔叶红松林下土壤枯叶分解过程中微生物学特性的研究[J]. 生态学杂志, 1987, 6(3): 6-13 (  0) 0) |
| [31] |
王京法. 滇池底泥细菌、放线菌的空间分布及细菌磷转化的研究[D]. 南京: 南京农业大学, 2004.
(  0) 0) |
| [32] |
郭梨锦, 曹凑贵, 张枝盛, 等. 耕作方式和秸秆还田对稻田表层土壤微生物群落的短期影响[J]. 农业环境科学学报, 2013, 32(8): 1577-1584 (  0) 0) |
| [33] |
Kunito T, Nagaoka K. Effects of plant litter type and additions of nitrogen and phosphorus on bacterial community-level physiological profiles in a brown forest soil[J]. Microbes and Environments, 2009, 24(1): 68-71 (  0) 0) |
| [34] |
黄冬芬, 毛懋, 张洁, 等. 低浓度镉对柱花草土壤细菌的影响[J]. 热带农业科学, 2012, 32(12): 59-63 (  0) 0) |
| [35] |
张雷. 不同给水和施肥条件对土壤微生物多样性的影响[D]. 哈尔滨: 东北林业大学, 2009.
(  0) 0) |
| [36] |
Neilson J W, Quade J, Ortiz M, et al. Life at the hyperarid margin: novel bacterial diversity in arid soils of the Atacama Desert, Chile[J]. Extremophiles, 2012, 16(3): 553-566 (  0) 0) |
2. State Experimental Station of Agro-Ecosystem in Fengqiu, State Key Laboratory of Soil and Sustainable Agriculture, Institute of Soil Science, Chinese Academy of Sciences, Nanjing 210008, China
 2021, Vol. 53
2021, Vol. 53


