2. 南京师范大学环境学院, 南京 210023;
3. 合肥工业大学资源与环境工程学院, 合肥 230009;
4. 南京农业大学资源与环境科学学院, 南京 210095;
5. 生态环境部南京环境科学研究所, 南京 210042
农药是用于预防、控制和消灭害虫、杂草、有害微生物的物质或混合物[1],在防治农业病虫害、保证作物产量等方面起到了关键作用。然而,由于人类在农药使用过程中存在不合理利用现象,如农药加工过程中所产生的有毒有害废物未经合理处置,或由于农药过量使用、滥用,而造成土壤农药残留超标[1-2]。目前,常见有三类农药污染土壤,即有机氯类、有机磷类和拟除虫菊酯类[3]。吸附于土壤颗粒上的农药,不仅破坏土壤结构和功能、影响农产品质量,还可通过皮肤接触、食物链传递等途径进入人体,造成生物体中毒[4],甚至造成三致效应。
生物刺激法修复农药污染土壤是通过添加营养物质、表面活性剂等刺激土著微生物活性或提高农药生物可利用性[5],从而提升微生物对农药污染土壤修复效果的生物修复技术,具有高效降解污染物的优势,已成为环境科学领域的研究热点。本文综述了近年来国内外学者关于生物刺激技术修复农药污染土壤的典型研究,对常见的生物刺激技术种类进行了总结,探讨了影响修复效果的主要因素,提出了该技术当前面临的问题,并对未来的研究方向和发展趋势进行了展望,以为农药污染土壤生物刺激修复技术的发展提供理论基础和科学支撑。
1 生物刺激法修复农药污染土壤 1.1 生物刺激法的定义、范畴和特点目前,农药污染土壤的治理可分为物理、化学和生物修复法等。生物修复包括土壤微生物、植物、动物修复等[1, 6],具有经济低耗、适用范围广、无二次污染、对环境扰动性小等优点,在农药污染土壤治理中具有较大应用潜力[2, 7]。其中,生物刺激是通过向土壤环境中添加一种或多种营养物质、表面活性剂等刺激土著微生物活性或提高农药生物可利用性,以提高农药污染物生物降解速率为目标的生物修复技术[5, 8](图 1),具有安全、高效、环境友好等特点[9]。
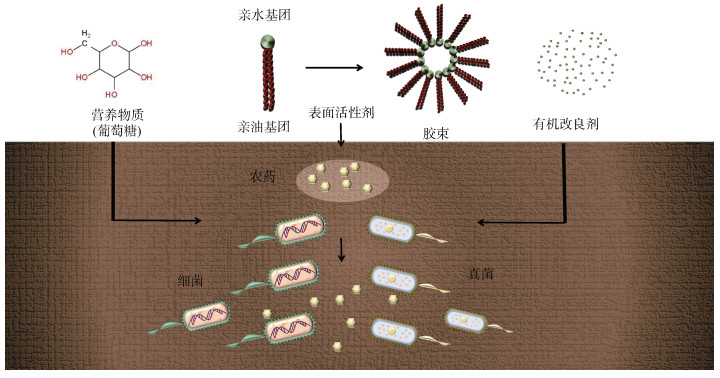
|
图 1 不同种类生物刺激剂对农药污染土壤的修复 Fig. 1 Remediation of pesticide contaminated soil by different kinds of biostimulants |
根据生物刺激剂的作用对象不同,可将其主要分为改善土著微生物生长环境的生物刺激剂,如营养底物,以及促进农药被微生物吸收利用的生物刺激剂,如表面活性剂。此外,通氧、控制水分等措施也是较为常见的生物刺激法[8, 10]。本文重点从营养底物、表面活性剂、有机改良剂等角度阐述生物刺激的方法,并分析不同种类生物刺激剂对农药污染土壤的修复效果,如表 1所示。
|
|
表 1 不同种类生物刺激剂对农药污染土壤的修复效果 Table 1 Remediation effects of different kinds of biostimulants on pesticide contaminated soil |
营养底物作为生物刺激剂,是指向农药污染土壤中添加含有微生物生长所必需的含有碳氮等营养元素的物质,以作为刺激土著微生物生长的养分基质。该方法可改善土壤中土著微生物的生活环境,增强降解功能菌群活性,从而提升农药降解效果。
王辉等[11]在有机氯农药滴滴涕(DDT) 含量为4.8×10-2 mg/kg污染的土壤中,分别探究添加葡萄糖、血粉氨基酸物料、乳化油这3种营养物质对土壤有机氯农药去除率的影响,发现150 d后,3种营养底物均使得土壤中DDT降解菌数量显著增加,分别达到4.4、4.2和4.3 log10CFUs/g干土,DDT去除率约为24.2%、32.5% 和21.7%。此外,这3种营养物质中,血粉氨基酸物料在1个月时修复效果并不理想,但5个月后土壤修复效率显著高于另外两种物料。这可能是由于血粉氨基酸物料是一种疏水性强的颗粒物质,很难随土壤物质进行迁移,能够较稳定地吸附到土壤颗粒中,故与水溶性较好的葡萄糖和乳化油相比,血粉氨基酸物料在修复周期较长的农药污染场地土壤中可能更有效。Betancur-Corredor等[12]研究了磷酸二氢钾(KH2PO4)和尿素(CO(NH2)2)作为营养底物对DDT含量为100.0 mg/kg土壤的生物刺激效果,发现56 d后,自然衰减条件下的对照组DDT去除率仅为4.3%,而添加营养底物后DDT去除率达到94.3%,并且观察到当试验进行到第二、第三周时土壤细菌数量出现迅速增长。这种现象可能是因为细菌的生存强烈依赖于污染土壤中的碳源、氮源含量,人为添加含碳、含氮物质后,促进了细菌的生长繁殖,从而提升了其对DDT的降解效果。
Garg等[13]在六氯环己烷浓度为4.9 mg/kg的污染土壤中,探究磷酸铵(0.5%,m/m)和糖蜜(1.0%,m/m)溶液作为营养物质对土壤农药去除率的影响,64 d后,发现自然衰减下六氯环己烷含量未发生显著变化,而生物刺激下土壤中六氯环己烷含量从4.9 mg/kg降为2.4 mg/kg,去除率达到51.0%。Gupta等[26]也做过类似研究,同样以糖蜜溶液(1.0%,m/m)和磷酸铵溶液(0.5%,m/m)作为营养物质,发现糖蜜和磷酸铵溶液联合处理对六氯环己烷污染土壤修复效果最佳,其次是糖蜜与磷酸铵单独处理,而未添加任何营养物质的对照组中六氯环己烷含量未发生显著变化;并且还发现糖蜜和磷酸铵联合处理使得土壤六氯环己烷降解菌的数量也显著增长。这表明,营养底物的加入可以为土著微生物生长提供碳源、氮源、磷源,促进了土著微生物数量增长,从而提高土壤六氯环己烷去除率。
Xu等[14]将除草剂阿特拉津污染的土壤悬浮在培养基中,观察利用葡萄糖作为营养底物对阿特拉津降解率的影响,结果显示,与对照组相比,含葡萄糖的培养基由于营养丰富,使得土壤微生物总量可增加2倍~ 5倍,阿特拉津降解速度提高约2倍。此外,与质量浓度为0.5%、1.0% 葡萄糖相比,阿特拉津在葡萄糖质量浓度为1.5% 时降解速度更快,表明相对较高浓度的葡萄糖可能更有利于阿特拉津的去除。Guo等[15]在除草剂西马津含量为200.0 mg/kg的土壤中添加蔗糖和节杆菌菌株Arthrobacter SD3-25,探究蔗糖对节杆菌菌株降解土壤中西玛津的影响,7 d后,发现向土壤中加入200.0 mg/kg蔗糖作为营养底物,使得阿特拉津氯水解酶基因atzA、羟基阿特拉津脱乙胺基水解酶基因atzB和N-异丙基氰尿酰氨异丙氨基水解酶基因atzC丰度增加,从而增强SD3-25菌株对西玛津的降解作用,土壤中西玛津降解率达到94.0%;但同时发现,当添加2 000.0 mg/kg蔗糖时,土壤修复效果并没有显著增强,表明过量添加蔗糖不会进一步提高土壤中西玛津降解率。
1.2.2 表面活性剂表面活性剂是指具有固定亲水亲油基团,在溶液表面能定向排列,且能降低液体表面张力的一类物质。它对疏水性有机化合物有增溶作用,能提高其生物可利用性[27],而农药绝大多数为疏水性有机化合物,故表面活性剂也是常用的生物刺激剂。
Regar等[16]以14.7 mg/kg六氯环己烷、DDT等有机氯农药污染的土壤为研究对象,探究表面活性剂鼠李糖脂和聚乙二醇辛基苯基醚(Triton X-100)对土壤修复效果的影响,发现自然衰减45 d后,六氯环己烷降解率仅为23.0%,而施用表面活性剂鼠李糖脂和Triton X-100的土壤中六氯环己烷降解率分别达到53.0% 和57.0%。Singh等[17]在土壤悬浮液中添加生物表面活性剂鼠李糖脂,探究其对50.0 mg/kg有机磷农药毒死蜱污染土壤修复效果的影响,结果显示,在生物表面活性剂鼠李糖脂存在下,经过2、4和6 d后,毒死蜱降解率分别为55.4%、70.5% 和82.3%,显著高于未添加生物表面活性剂时的33.0%、45.2% 和52.3%。Singh和Cameotra[18]以250.0 mg/kg除草剂阿特拉津污染土壤为研究对象,研究表面活性剂鼠李糖脂和Triton X-100的使用对阿特拉津降解率的影响,发现6 d后,自然状态下阿特拉津每日降解量为2.5 mg/kg,但单独施加2.5倍临界胶束浓度的鼠李糖脂和Triton X-100后,阿特拉津每日降解量分别提高到21.1 mg/kg和13.9 mg/kg,土壤阿特拉津降解率分别达到84.8% 和70.0%。
通过上述案例可以发现,疏水性农药的低溶解度限制其生物可利用性使其在土壤中降解缓慢,而表面活性剂分子两端同时含有亲水基和亲油基,其特殊结构有利于增强疏水性化合物的水溶性,降低水土界面张力,促进土壤中吸附态疏水性农药向液相释放[28],从而增强疏水性农药生物可利用性,提高土壤中农药的降解率[29-30]。
1.2.3 有机改良剂人类在进行生产活动过程中会产生一部分副产物如污泥、粪肥、植物残体等,其中有些有机副产物含有能够被微生物利用的物质,将其进行回收利用,可增加土壤有机质含量,增强土著微生物活性,促进土壤中农药降解[31]。
Aceves-Diez等[19]以苏云金芽孢杆菌(Bacillus thuringiensis)发酵的上清液作为生物刺激剂,研究其对土壤中毒死蜱(70.0 mg/kg)去除率的影响,80 d后,发现添加有机改良剂进行处理的土壤比对照组中毒死蜱浓度降低39.4%。这是由于苏云金芽孢杆菌上清液营养丰富,不仅可缓解毒死蜱对脱氢酶、脲酶、磷酸酶等活性的抑制作用,而且使得土壤中细菌、真菌,放线菌数量分别增加140.4%、102.8%、74.8%,有利于毒死蜱污染土壤的生物修复。Pimmata等[20]以含有20.0 mg/kg氨基甲酸酯类农药呋喃丹的土壤为研究对象,探究可再生能源氢、乙醇和甲烷生产过程中产生的污泥作为有机改良剂对土壤修复效果的影响,发现与自然衰减相比,添加3种有机改良剂能显著提高土壤中呋喃丹的降解效率,其中添加氢发酵过程产生的污泥效果最佳,呋喃丹半衰期缩短为9.5 d,仅为自然衰减条件下1/2。
综上所述,有机改良剂含有微生物所必需的碳、氮等营养物质,促进了土著微生物生长和繁殖,使得降解农药的菌群活性增强,从而加速土壤中农药降解。
1.2.4 混合生物刺激剂为了提升生物刺激技术的修复效率,强化修复效果,一些研究将表面活性剂与微生物生长所需的营养底物或有机改良剂联用,探究混合生物刺激剂对农药污染土壤修复效果的影响。
Rubio-Bellido等[21]以50.0 mg/kg敌草隆污染土壤为研究对象,使用两种有机改良剂即城市固体废弃物(有机物含量70.0%),以及污泥与修建残渣混合体(有机物含量22.0%),探究有机改良剂与羟丙基-β-环糊精对敌草隆矿化作用的影响,发现150 d后,对照组中敌草隆矿化率为15.5%,而在土壤中添加羟丙基-β-环糊精,敌草隆矿化程度可达到29.7%,约为对照组2倍;单独添加4.0%(m/m)城市固体废弃物或污泥与修建残渣混合体,矿化率分别为33.1%、32.9%;而将羟丙基-β-环糊精和污泥与修建残渣混合体联用,敌草隆矿化率可达到46.5%,且半衰期也仅为对照组1/36。这是由于环糊精具有疏水腔和强亲水性外部,这种特殊结构允许有机分子通过非共价键进入腔内形成包合物,从而促进敌草隆溶解,提高其生物可利用性;而有机改良剂中含有的有机物还可作为土壤微生物碳源,有机物、羟丙基-β-环糊精和敌草隆形成的包合物共同作用促进了土壤中敌草隆的矿化。
Ye等[22]在16.0 mg/kg有机氯农药氯丹、六氯环己烷和硫丹污染土壤中,探究硝酸盐(KNO3)和甲基-β-环糊精对有机氯农药厌氧生物降解的影响,试验180 d后,发现同时添加硝酸盐和甲基β-环糊精条件下,土壤中有机氯农药生物降解总量最高,去除率达到67.1%,而对照组仅为2.9%。这是由于甲基β-环糊精是具有亲水外部和疏水空腔的环状大分子,可通过与疏水性有机氯农药形成配合物来提高有机氯农药溶解度,使得土壤中有机氯农药生物可利用性增强,有利于微生物降解。江利梅等[32]研究表明,某些微生物在厌氧条件下可将硝酸盐作为电子受体进行呼吸代谢,并与有机污染物的降解相耦合。因此,硝酸盐的添加可促进反硝化过程、刺激土著微生物活性,进而提高有机氯农药的降解率。
1.2.5 其他生物刺激法潘声旺等[23]采用模拟修复试验的方法,研究苏丹草根系分泌物对土壤中DDT、六氯环己烷、硫丹等有机氯农药降解的影响,农药初始含量为66.7 ~ 343.6 mg/kg,试验20 d后,发现施加根系分泌物后,土壤有机氯农药去除率高达79.3%,而对照组去除率仅为42.5%。这是由于一方面根系分泌物含有某些胞外酶能够直接参与有机氯农药降解;另一方面,根系分泌物处理组土壤微生物碳含量是对照组2倍,分泌物中的可溶性糖、低分子量有机酸、氨基酸等物质可为土著微生物提供碳源,促进微生物种群数量增长,从而提高有机氯农药去除率。
Chen等[24]探究了不同浓度腐殖质类似物蒽醌-2, 6-二磺酸对微生物群落的生物刺激作用及其对土壤中五氯酚厌氧转化的影响,培养30 d后,发现加入20.0 mmol/L腐殖质类似物蒽醌-2, 6-二磺酸的土壤中五氯酚转化率最高,可达65.9%。地杆菌(Geobacter sp.)可能具有降解五氯酚的潜力[33],而Chen等[24]试验中土壤地杆菌(Geobacter sp.)受到腐殖质类似物蒽醌-2, 6-二磺酸的刺激而活性增强,相对丰度约提高2.7倍,进而提高了土壤中五氯酚的转化率。
Jiang等[25]在阿特拉津浓度为100.0 mg/L的培养基中,探究溶磷细菌肠杆菌Enterobacter sp. P1对阿特拉津降解菌节杆菌DNS10功能活性的影响,培养48 h后,发现两株菌株共培养时阿特拉津降解率高达99.2%,而单株菌株DNS10时的降解率仅为38.6%;同时阿特拉津降解相关基因trzN、atzB和atzC在共培养处理中表达量分别是DNS10单株培养处理的6.6倍、1.8倍和3.1倍。这表明溶磷细菌P1虽不具有降解阿特拉津的能力,但与阿特拉津降解菌DNS10共同培养可促进阿特拉津生物降解。这可能是由于菌株P1的分泌物,特别是小分子量有机酸,可促进阿特拉津降解相关基因表达;此外,阿特拉津代谢产物异丙胺对阿特拉津的降解有潜在抑制作用,而P1可利用异丙胺作为氮源,缓解其对DNS10菌株降解阿特拉津的制约效应,从而提高阿特拉津降解率。可见,菌株互作或可成为一种有效的生物刺激策略。
2 影响生物刺激法修复农药污染土壤效果的因素 2.1 土壤理化性质土壤的理化性质,如土壤质地、温度、有机质含量、pH和氧化还原电位对生物刺激法修复农药污染土壤存在显著影响[34]。有证据表明,土壤质地影响土壤农药去除[35]。如黏土具有较高的持水能力,通气性通常较差[36],但黏土有较大比表面积,使得微生物潜在活性位点数量较多[37],有利于污染物生物降解。然而,该性质也使得农药易被吸附在黏土颗粒中,从而限制农药的生物可利用性和生物降解性[38]。土壤温度影响土著微生物活动以及农药降解速率,在一定范围内,通常土壤中有机化合物的降解速率会随着温度的升高而增加[39]。土壤有机质不仅是土壤中许多有机污染物吸附、迁移和转化的主要影响因素[40],而且有机质含量高的土壤中,土著微生物活性相对较高,有利于土壤中农药降解[41]。同时,土著微生物都需要水分来促进细胞生长和维持生理功能[39],且土壤含水量还可调节土壤pH[37],也会影响农药污染土壤修复效果。大多数微生物只能在一定pH范围内生存[39],如细菌在接近中性的pH时对农药降解效果较好,而真菌则在酸性条件下更有利于土壤农药降解[40]。此外,土壤中水分和有机质还可影响土壤氧化还原电位,土壤重金属的价态变化及生物毒性与土壤氧化还原电位状况变化有着密切关系[42],因此土壤氧化还原电位也是影响农药(如重金属类农药)在土壤中持久性的一个重要因素[43]。
2.2 农药种类与性质不同种类的农药由于其自身性质不同,也会影响生物刺激剂选择及修复农药污染土壤效果。有机氯农药具有持久性、蓄积性和高脂溶性等特点[44],化学性质稳定,半衰期长。农药半衰期是农药在自然界中稳定性和持久性的标志。农药自身化学稳定性及环境条件从根本上决定了农药污染土壤修复周期的长短。有机氯农药抗降解能力强,在土壤中残留时间长[45]。此类农药更适于选用表面活性剂作为生物刺激剂,通过增强有机氯农药的水溶性,提高其生物降解性;另外,可通过施加适量的营养物质作为辅助,增强土壤微生物活性,促进有机氯农药降解。有机磷农药溶解性较好,容易被水解[46],营养物质或有机改良剂是建议优先选择的生物刺激剂。但某些有机磷农药如毒死蜱,其降解代谢产物比母体化合物毒性更强,且对土著微生物活性有强抑制作用[47],限制了微生物的降解效果。此类农药应优先考虑对代谢产物有解毒作用的生物刺激剂。吡啶类除草剂如百草枯,半衰期较长,约为3 ~ 6.6年[48],且在土壤中易被强烈吸附[45],使得农药生物可利用性降低;而拟除虫菊酯类农药具有高度疏水性和亲脂性,易与土壤颗粒及有机物紧密结合[35],但大多数拟除虫菊酯类农药半衰期较短,且一般情况下降解中间产物比农药本体毒性更小,甚至无毒[49],因此,吡啶类除草剂与拟除虫菊酯类农药也建议将表面活性剂作为发挥主导作用的生物刺激剂。
2.3 生物刺激剂的种类与性质不同类型生物刺激剂的作用机理不同。如添加微生物生长所必须的营养物质,可促进土著微生物生长,从而增加土壤中农药去除率;而表面活性剂则是通过提高疏水性有机污染物溶解度的方式来提高农药生物可利用性,进而促进农药降解[50],通常生物表面活性剂比化学表面活性剂更加环境友好,且不同表面活性剂由于胶束体积差异也会影响其对农药的增溶效果[18],从而影响微生物对农药的降解。此外,某些生物刺激剂的使用固然会促进土壤中农药降解,但过量添加修复效率或许并不会上升,反而可能导致微生物代谢活性和多样性受到抑制[51-52]。
3 研究不足与未来发展趋势现阶段,采用生物刺激技术修复农药污染土壤还存在一些不足:①生物刺激剂的作用效果受土壤性质、微生物种类、污染物特性等多种因素影响[53]。如添加表面活性剂可以刺激土壤微生物活性,但使用不当也可能起反作用[7, 12],甚至对生物体造成严重损害[54],因此必须因地制宜选择合适的生物刺激剂[18]。②一些化学结构复杂的生物刺激剂难被生物降解,且自身及生产过程的副产品可能对环境起毒害作用[55]。③部分生物刺激剂因生产工艺复杂、原材料成本高,导致价格高昂,使其推广使用受到限制[53]。④目前,该技术在实验室或者理想条件下进行试验较多,原位环境下有较多局限因素,可能会影响生物刺激技术实际修复效果[50, 56-57]。
基于上述研究现状,未来需要进行大量且细致的研究工作:
1) 研发环境友好的生物刺激剂生产工艺。由于现有技术存在工艺复杂、原材料成本高等问题,故探究快捷高效的工艺,开发性价比高、环境友好的生物刺激剂十分必要;同时,还应关注生物刺激剂在污染修复过程中及修复后是否存在潜在的二次生态毒理风险。
2) 探明土壤体系中生物刺激剂与微生物的生态关系。采用分子生物学技术,并结合经典土壤化学与土壤生物学知识,深入研究生物刺激剂与微生物二者之间的作用机理,以阐明农药污染土壤生物刺激修复过程的微生物生态学分子机制,为选择合适的生物刺激剂提供科学指导。
3) 扩大场地示范研究。进行试点试验,加快推进典型农药污染场地生物刺激修复示范工程的建设,逐步建立农药污染土壤生物刺激修复技术导则和标准,为生物刺激法修复农药污染土壤的生态风险管控提供科学依据;此外,还应该逐步规范工艺技术流程,最终实现修复技术的推广应用。
| [1] |
Morillo E, Villaverde J. Advanced technologies for the remediation of pesticide-contaminated soils[J]. Science of the Total Environment, 2017, 586: 576-597 DOI:10.1016/j.scitotenv.2017.02.020 (  0) 0) |
| [2] |
高寒, 陈娟, 王沛芳, 等. 农药污染土壤的生物强化修复技术研究进展[J]. 土壤, 2019, 51(3): 425-433 (  0) 0) |
| [3] |
Briceño G, Fuentes M S, Saez J M, et al. Streptomyces genus as biotechnological tool for pesticide degradation in polluted systems[J]. Critical Reviews in Environmental Science and Technology, 2018, 48(10/11/12): 773-805 (  0) 0) |
| [4] |
张娜娜, 姜博, 邢奕, 等. 有机磷农药污染土壤的微生物降解研究进展[J]. 土壤, 2018, 50(4): 645-655 (  0) 0) |
| [5] |
Qureshi A, Mohan M, Kanade G S, et al. In situ bioremediation of organochlorine-pesticide-contaminated microcosm soil and evaluation by gene probe[J]. Pest Management Science, 2009, 65(7): 798-804 DOI:10.1002/ps.1757 (  0) 0) |
| [6] |
Eevers N, White J C, Vangronsveld J, et al. Bio- and phytoremediation of pesticide-contaminated environments: A review[J]. Advances in Botanical Research, 2017, 83: 277-318 (  0) 0) |
| [7] |
Olaniran A O, Balgobind A, Pillay B. Bioavailability of heavy metals in soil: impact on microbial biodegradation of organic compounds and possible improvement strategies[J]. International Journal of Molecular Sciences, 2013, 14(5): 10197-10228 DOI:10.3390/ijms140510197 (  0) 0) |
| [8] |
Helbling D E. Bioremediation of pesticide-contaminated water resources: The challenge of low concentrations[J]. Current Opinion in Biotechnology, 2015, 33: 142-148 DOI:10.1016/j.copbio.2015.02.012 (  0) 0) |
| [9] |
An Y L, Zhang L Y, Liu N, et al. Biostimulation-enhanced biodegradation of nitrobenzene in contaminated groundwater[J]. Chemical Research in Chinese Universities, 2012, 28(5): 818-823 (  0) 0) |
| [10] |
Hamoudi-Belarbi L, Nouri L, Bendifallah L, et al. Biostimulation of microbial community by carob (Ceratonia siliqua) to degrade total petroleum hydrocarbon (TPH) in contaminated soil[C]//Recent Advances in Environmental Science from the Euro-Mediterranean and Surrounding Regions. Cham: Springer International Publishing Ag, 2018: 275-276.
(  0) 0) |
| [11] |
王辉, 刘春跃, 荣璐阁, 等. 生物刺激法修复DDTs污染农田土壤研究[J]. 生态科学, 2017, 36(6): 207-212 (  0) 0) |
| [12] |
Betancur-Corredor B, Pino N J, Cardona S, et al. Evaluation of biostimulation and Tween 80 addition for the bioremediation of long-term DDT-contaminated soil[J]. Journal of Environmental Sciences, 2015, 28: 101-109 DOI:10.1016/j.jes.2014.06.044 (  0) 0) |
| [13] |
Garg N, Lata P, Jit S, et al. Laboratory and field scale bioremediation of hexachlorocyclohexane (HCH) contaminated soils by means of bioaugmentation and biostimulation[J]. Biodegradation, 2016, 27(2/3): 179-193 (  0) 0) |
| [14] |
Xu X H, Zarecki R, Medina S, et al. Modeling microbial communities from atrazine contaminated soils promotes the development of biostimulation solutions[J]. The ISME Journal, 2019, 13(2): 494-508 DOI:10.1038/s41396-018-0288-5 (  0) 0) |
| [15] |
Guo Q W, Zhang J X, Wan R, et al. Impacts of carbon sources on simazine biodegradation by Arthrobacter strain SD3-25 in liquid culture and soil microcosm[J]. International Biodeterioration & Biodegradation, 2014, 89: 1-6 (  0) 0) |
| [16] |
Regar R K, Gaur V K, Bajaj A, et al. Comparative microbiome analysis of two different long-term pesticide contaminated soils revealed the anthropogenic influence on functional potential of microbial communities[J]. Science of the Total Environment, 2019, 681: 413-423 DOI:10.1016/j.scitotenv.2019.05.090 (  0) 0) |
| [17] |
Singh P, Saini H S, Raj M. Rhamnolipid mediated enhanced degradation of chlorpyrifos by bacterial consortium in soil-water system[J]. Ecotoxicology and Environmental Safety, 2016, 134: 156-162 DOI:10.1016/j.ecoenv.2016.07.020 (  0) 0) |
| [18] |
Singh A K, Cameotra S S. Influence of microbial and synthetic surfactant on the biodegradation of atrazine[J]. Environmental Science and Pollution Research, 2014, 21(3): 2088-2097 DOI:10.1007/s11356-013-2127-6 (  0) 0) |
| [19] |
Aceves-Diez A E, Estrada-Castañeda K J, Castañeda-Sandoval L M. Use of Bacillus thuringiensis supernatant from a fermentation process to improve bioremediation of chlorpyrifos in contaminated soils[J]. Journal of Environmental Management, 2015, 157: 213-219 (  0) 0) |
| [20] |
Pimmata P, Reungsang A, Plangklang P. Comparative bioremediation of carbofuran contaminated soil by natural attenuation, bioaugmentation and biostimulation[J]. International Biodeterioration & Biodegradation, 2013, 85: 196-204 (  0) 0) |
| [21] |
Rubio-Bellido M, Madrid F, Morillo E, et al. Assisted attenuation of a soil contaminated by diuron using hydroxypropyl-β-cyclodextrin and organic amendments[J]. Science of the Total Environment, 2015, 502: 699-705 DOI:10.1016/j.scitotenv.2014.09.052 (  0) 0) |
| [22] |
Ye M, Sun M M, Ni N, et al. Role of cosubstrate and bioaccessibility played in the enhanced anaerobic biodegradation of organochlorine pesticides (OCPs) in a paddy soil by nitrate and methyl-β-cyclodextrin amendments[J]. Environmental Science and Pollution Research, 2014, 21(13): 7785-7796 DOI:10.1007/s11356-014-2703-4 (  0) 0) |
| [23] |
潘声旺, 雷志华, 吴云霄, 等. 苏丹草根分泌物在有机氯农药降解过程中的作用[J]. 中国环境科学, 2017, 37(8): 3072-3079 DOI:10.3969/j.issn.1000-6923.2017.08.032 (  0) 0) |
| [24] |
Chen M J, Tong H, Liu C S, et al. A humic substance analogue AQDS stimulates Geobacter sp abundance and enhances pentachlorophenol transformation in a paddy soil[J]. Chemosphere, 2016, 160: 141-148 DOI:10.1016/j.chemosphere.2016.06.061 (  0) 0) |
| [25] |
Jiang Z, Zhang X Y, Wang Z Y, et al. Enhanced biodegradation of atrazine by Arthrobacter sp. DNS10 during co-culture with a phosphorus solubilizing bacteria: Enterobacter sp. P1[J]. Ecotoxicology and Environmental Safety, 2019, 172: 159-166 DOI:10.1016/j.ecoenv.2019.01.070 (  0) 0) |
| [26] |
Gupta S K, Lal D, Lata P, et al. Changes in the bacterial community and Lin genes diversity during biostimulation of indigenous bacterial community of hexachlorocyclohexane (HCH) dumpsite soil[J]. Microbiology, 2013, 82(2): 234-240 DOI:10.1134/S0026261713020185 (  0) 0) |
| [27] |
Robles-González I V, Ríos-Leal E, Sastre-Conde I, et al. Slurry bioreactors with simultaneous electron acceptors for bioremediation of an agricultural soil polluted with lindane[J]. Process Biochemistry, 2012, 47(11): 1640-1648 DOI:10.1016/j.procbio.2011.10.013 (  0) 0) |
| [28] |
熊佰炼. 表面活性剂增溶微生物—光催化联合降解污染土壤中的硫丹[D]. 重庆: 西南大学, 2013.
(  0) 0) |
| [29] |
Manickam N, Bajaj A, Saini H S, et al. Surfactant mediated enhanced biodegradation of hexachlorocyclohexane (HCH) isomers by Sphingomonas sp. NM05[J]. Biodegradation, 2012, 23(5): 673-682 DOI:10.1007/s10532-012-9543-z (  0) 0) |
| [30] |
Gaur V K, Bajaj A, Regar R K, et al. Rhamnolipid from a Lysinibacillus sphaericus strain ⅡTR51 and its potential application for dissolution of hydrophobic pesticides[J]. Bioresource Technology, 2019, 272: 19-25 DOI:10.1016/j.biortech.2018.09.144 (  0) 0) |
| [31] |
Fenoll J, Vela N, Navarro G, et al. Assessment of agro-industrial and composted organic wastes for reducing the potential leaching of triazine herbicide residues through the soil[J]. Science of the Total Environment, 2014, 493: 124-132 DOI:10.1016/j.scitotenv.2014.05.098 (  0) 0) |
| [32] |
江利梅, 陈杏娟, 马连营, 等. 硝酸盐还原促进毒害性有机污染物降解的研究进展[J]. 微生物学通报, 2014, 41(8): 1661-1666 (  0) 0) |
| [33] |
冯小莉. 水稻土混合菌群耦合铁氧化物对五氯酚还原转化的作用与机制[D]. 杭州: 浙江大学, 2014.
(  0) 0) |
| [34] |
谢慧, 王军, 杜晓敏, 等. 新农药哌虫啶在三种典型土壤中的吸附与淋溶研究[J]. 土壤学报, 2017, 54(1): 118-127 (  0) 0) |
| [35] |
Cycoń M, Piotrowska-Seget Z. Pyrethroid-degrading microorganisms and their potential for the bioremediation of contaminated soils: A review[J]. Frontiers in Microbiology, 2016, 7: 26 (  0) 0) |
| [36] |
Saez J M, Bigliardo A L, Raimondo E E, et al. Lindane dissipation in a biomixture: Effect of soil properties and bioaugmentation[J]. Ecotoxicology and Environmental Safety, 2018, 156: 97-105 DOI:10.1016/j.ecoenv.2018.03.011 (  0) 0) |
| [37] |
Raimondo E E, Saez J M, Aparicio J D, et al. Coupling of bioaugmentation and biostimulation to improve lindane removal from different soil types[J]. Chemosphere, 2020, 238: 124512 DOI:10.1016/j.chemosphere.2019.124512 (  0) 0) |
| [38] |
Fuentes M S, Raimondo E E, Amoroso M J, et al. Removal of a mixture of pesticides by a Streptomyces consortium: Influence of different soil systems[J]. Chemosphere, 2017, 173: 359-367 DOI:10.1016/j.chemosphere.2017.01.044 (  0) 0) |
| [39] |
Odukkathil G, Vasudevan N. Toxicity and bioremediation of pesticides in agricultural soil[J]. Reviews in Environmental Science and Bio/Technology, 2013, 12(4): 421-444 DOI:10.1007/s11157-013-9320-4 (  0) 0) |
| [40] |
Briceño G, Palma G, Durán N. Influence of organic amendment on the biodegradation and movement of pesticides[J]. Critical Reviews in Environmental Science and Technology, 2007, 37(3): 233-271 DOI:10.1080/10643380600987406 (  0) 0) |
| [41] |
Albarrán A, Celis R, Hermosı́n M C, et al. Behaviour of simazine in soil amended with the final residue of the olive-oil extraction process[J]. Chemosphere, 2004, 54(6): 717-724 DOI:10.1016/j.chemosphere.2003.09.004 (  0) 0) |
| [42] |
苏长青. 铬污染土壤中Cr(Ⅵ)的微生物还原及Cr(Ⅲ)的稳定性研究[D]. 长沙: 中南大学, 2010.
(  0) 0) |
| [43] |
黎雅楠, 熊宇斐. 土壤氧化还原电位的研究及应用[J]. 农技服务, 2019, 36(9): 49-50, 52 (  0) 0) |
| [44] |
朱英月, 刘全永, 李贺, 等. 辽东与山东半岛土壤中有机氯农药残留特征研究[J]. 土壤学报, 2015, 52(4): 888-901 (  0) 0) |
| [45] |
Jayaraj R, Megha P, Sreedev P. Organochlorine pesticides, their toxic effects on living organisms and their fate in the environment[J]. Interdisciplinary Toxicology, 2016, 9(3/4): 90-100 (  0) 0) |
| [46] |
Bilal M, Iqbal H M N, Barceló D. Persistence of pesticides-based contaminants in the environment and their effective degradation using laccase-assisted biocatalytic systems[J]. Science of the Total Environment, 2019, 695: 133896 DOI:10.1016/j.scitotenv.2019.133896 (  0) 0) |
| [47] |
Abraham J, Silambarasan S, Logeswari P. Simultaneous degradation of organophosphorus and organochlorine pesticides by bacterial consortium[J]. Journal of the Taiwan Institute of Chemical Engineers, 2014, 45(5): 2590-2596 DOI:10.1016/j.jtice.2014.06.014 (  0) 0) |
| [48] |
Huang Y H, Zhan H, Bhatt P, et al. Paraquat degradation from contaminated environments: current achievements and perspectives[J]. Frontiers in Microbiology, 2019, 10: 1754 DOI:10.3389/fmicb.2019.01754 (  0) 0) |
| [49] |
李玲玉, 刘艳, 颜冬云, 等. 拟除虫菊酯类农药的降解与代谢研究进展[J]. 环境科学与技术, 2010, 33(4): 65-71 DOI:10.3969/j.issn.1003-6504.2010.04.016 (  0) 0) |
| [50] |
Alvarez A, Saez J M, Davila Costa J S, et al. Actinobacteria: Current research and perspectives for bioremediation of pesticides and heavy metals[J]. Chemosphere, 2017, 166: 41-62 DOI:10.1016/j.chemosphere.2016.09.070 (  0) 0) |
| [51] |
Azubuike C C, Chikere C B, Okpokwasili G C. Bioremediation techniques-classification based on site of application: principles, advantages, limitations and prospects[J]. World Journal of Microbiology and Biotechnology, 2016, 32(11): 1-18 (  0) 0) |
| [52] |
Wang X, Wang Q H, Wang S J, et al. Effect of biostimulation on community level physiological profiles of microorganisms in field-scale biopiles composed of aged oil sludge[J]. Bioresource Technology, 2012, 111: 308-315 DOI:10.1016/j.biortech.2012.01.158 (  0) 0) |
| [53] |
Singh A, van Hamme J D, Ward O P. Surfactants in microbiology and biotechnology: Part 2. Application aspects[J]. Biotechnology Advances, 2007, 25(1): 99-121 DOI:10.1016/j.biotechadv.2006.10.004 (  0) 0) |
| [54] |
Santos V S V, Silveira E, Pereira B B. Toxicity and applications of surfactin for health and environmental biotechnology[J]. Journal of Toxicology and Environmental Health, Part B, 2018, 21(6/7/8): 382-399 (  0) 0) |
| [55] |
Makkar R, Cameotra S. An update on the use of unconventional substrates for biosurfactant production and their new applications[J]. Applied Microbiology and Biotechnology, 2002, 58(4): 428-434 DOI:10.1007/s00253-001-0924-1 (  0) 0) |
| [56] |
Srivastava V, Srivastava T, Kumar M S. Fate of the persistent organic pollutant (POP)Hexachlorocyclohexane (HCH) and remediation challenges[J]. International Biodeterioration & Biodegradation, 2019, 140: 43-56 (  0) 0) |
| [57] |
Singh P, Borthakur A. A review on biodegradation and photocatalytic degradation of organic pollutants: A bibliometric and comparative analysis[J]. Journal of Cleaner Production, 2018, 196: 1669-1680 DOI:10.1016/j.jclepro.2018.05.289 (  0) 0) |
2. School of Environment, Nanjing Normal University, Nanjing 210023, China;
3. School of Resources and Environmental Engineering, Hefei University of Technology, Hefei 230009, China;
4. College of Resources and Environmental Sciences, Nanjing Agricultural University, Nanjing 210095, China;
5. Nanjing Institute of Environmental Science, Ministry of Environmental Protection of China, Nanjing 210042, China
 2021, Vol. 53
2021, Vol. 53


