2. 中国科学院水利部成都山地灾害与环境研究所, 成都 610041
抗生素是指一类用于杀死或抑制存在于人类和动物宿主内细菌的天然、半合成或合成的化合物[1]。中国是世界上最大的抗生素生产国和使用国[2]。大量的抗生素残留于环境中,不仅会对微生物和动植物产生毒性效应,还会通过迁移转化进入到人类的食物和饮用水中,对人类健康造成潜在的风险[3]。磺胺类抗菌药(Sulfonamides,SAs)属于人畜共用抗菌药,经常用作药物类饲料添加剂添加到畜禽饲料中,用以防治细菌感染性畜禽疾病和促进畜禽生长[4]。添加到饲料中的SAs有50% ~ 90% 的部分以原形残留物或代谢产物形式随动物粪肥进入环境,尤其是土壤环境[5]。磺胺类抗生素在土壤中的吸附与迁移行为是影响抗生素在土壤环境中持久性和有效性的重要过程。
生物质炭是生物质在氧气受限制的条件下通过热解而成的多孔固态物质,因其作为改良剂在改善土壤质量方面的潜在应用而受到广泛关注[6-7]。大量研究表明,生物质炭可以高效地吸附固定多种有毒有机污染物,从而大大降低污染物在土壤/泥沙中的迁移能力及其潜在的环境风险[8]。生物质炭施入土壤后,由于田间不断变化的水热条件下多种生物与非生物的作用,其理化性质会发生变化,这种现象称为“老化”[9]。生物质炭的老化会对土壤中有机污染物(农药、抗生素等)的吸附行为产生影响,且因土壤类型、有机污染物种类等因素而异[10-11]。然而,有关生物质炭老化作用对吸附性相对较弱的有机污染物(特别是磺胺类抗生素)的迁移行为的影响研究非常缺乏。
紫色土在我国长江上游低山丘陵区广泛分布,存在土层浅薄、有机质含量低以及土壤大孔隙丰富等特点,弱吸附性农化物质及其他类型污染物等易随着土壤中大孔隙优先流发生快速的淋失迁移[12-13]。因此,本研究以川中丘陵区旱地石灰性紫色土为对象,采用室内批量平衡试验和填装土柱穿透试验,探究生物质炭及其田间老化对土壤中磺胺嘧啶和磺胺二甲基嘧啶吸附和迁移行为的影响,为紫色土地区该类污染物的迁移阻控及风险评估提供机理认识。
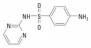
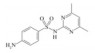
1 材料与方法 1.1 供试材料 1.1.1 药品与材料试验所用磺胺嘧啶(SD,纯度≥99.5%)和磺胺二甲基嘧啶(SMT,纯度≥99.5%)均购自德国Dr. Ehrenstorfer公司,基本性质见表 1[13]。生物质炭为商品炭,于河南商丘三利新能源有限公司购买,是农作物混合秸秆在500 ℃、无氧条件下热解制成的产品,其pH为10.2,比表面积为13.85 m2/g,含碳量为83.4%。乙腈为色谱纯,其他试剂(氯化钙、叠氮化钠)为分析纯。
|
|
表 1 目标抗生素的基本性质 Table 1 Basic properties of the investigated antibiotics |
高效液相色谱仪配荧光检测器、Eclipse plus C18色谱柱(4.6 mm × 150 mm) (1200,美国Agilent公司)、高效液相色谱-三重四级杆串联质谱仪(HPLC-MS-MS,1260-6410B,Agilent,美国)、冷冻干燥机(FD-1A-50,北京博医康实验仪器有限公司)、紫外吸收-三维激发-发射荧光光谱仪(Aqualog,日本Horiba JY公司)、pH计(Senslon+MM150,美国)、恒温振荡床(ZWF-200、上海智城分析仪器制造有限公司)等。
1.1.3 供试土壤供试土壤包括3种处理:对照土、田间老化3 a的1%施炭土、新鲜混合的1%施炭土。供试对照土壤为旱地石灰性紫色土,采自中国科学院盐亭紫色土农业生态试验站坡耕地小区,该试验站位于四川省盐亭县林山乡。2015年5月以1%(质量占比)的投加量将生物质炭施用于耕作层(0 ~ 20 cm)中,经过3 a田间干湿交替老化后,采集各试验小区土壤样品置于阴凉处风干,用研钵研磨后过10目筛后待用。将老化的施炭土中的生物质炭颗粒用镊子捡出,与新鲜生物质炭一起进行荧光特征的比较。批量平衡吸附与土柱试验前,将供试土壤在120 ℃、0.115 MPa条件下连续湿热灭菌2 h。
|
|
表 2 各处理土壤基本性质 Table 2 Basic properties of the soils with different treatments |
采用固液比为1:10 (m: V),称取1.0 g风干土样于30 ml离心管中,添加10 ml含两种抗生素(磺胺嘧啶与磺胺二甲基嘧啶)的混合溶液,设置各抗生素的浓度系列为0.5、1、5、10、20 mg/L(含支持电解质10 mmol/L CaCl2和灭菌用的0.1 g/L NaN3),设置3个重复,于25 ℃、避光、180 r/min的条件下恒温振荡24 h,使吸附达到平衡,以4 000 r/min离心10 min,移取上清液,经0.45 μm PTEF滤膜过滤后,测定滤液的抗生素浓度。
1.3 填装土柱抗生素迁移试验土柱迁移试验用于模拟降水或灌溉条件下土壤中有机污染物的迁移特征。饱和土柱试验系统由进样瓶、蠕动泵、土柱和部分收集器4部分组成,将采集的土壤依据田间实际容重填装于玻璃柱(内径2.4 cm、高15 cm)内。土柱穿透试验前,由下端以20 μl/min注入背景溶液(含0.1 g/L NaN3的10 mmol/L CaCl2),使水分通过毛细管进入土壤并接近饱和,然后悬放在室温下培养1 d。逐渐调快进水速度,使得进水速度达到20 mm/h,而后,以此速度淋洗5个孔隙体积(PV),使土柱达到物理与化学平衡。然后,加入含目标抗生素的溶液(100 mg/L Br(KBr溶液)、0.1 g/L NaN3、1 mg/L目标抗生素、10 mmol/L CaCl2溶液),当目标物溶液达到5个孔隙体积后停止进药,即刻注入背景溶液(含0.1 g/L NaN3的10 mmol/L CaCl2溶液),注入5个孔隙体积。土柱上端的出流液采用自动部分收集器收集,设置每隔50 min采一次样,测定其pH、电导率(EC)、溴离子含量、溶解性有机碳(DOC)浓度及其紫外-三维荧光光谱、各目标抗生素含量等。
1.4 检测分析方法 1.4.1 抗生素检测2种抗生素采用高效液相色谱仪同时检测,仪器参数:流动相为乙腈: 水= 25:75(体积比),进样量20 μl,流速0.8 ml/min,柱温30 ℃;紫外测定波长为270 nm,保留时间:磺胺嘧啶3.5 min,磺胺二甲基嘧啶5.3 min,2种抗生素的检测限均为0.05 mg/L,标准曲线的线性范围为0.1 ~ 5 mg/L(R2≥0.999)。
1.4.2 溶解性有机质检测出流液中溶解性有机质(DOM)组成采用紫外吸收-三维激发-发射荧光光谱仪分析,样品置于标准的1 cm石英比色皿中进行扫描,测试温度保持为25 ℃,积分间隔时间为0.5 s,激发波长为240 ~ 450 nm,发射波长为213.25 ~ 620.80 nm,以超纯水做空白,进行散射校正。
1.4.3 土样提取及检测方法将土壤样品冷冻干燥后,再研磨过60目筛。称取1.00 g样品,放入30 ml离心管中,加入2.5 ml甲醇和2.5 ml EDTA-Mc Ilvaine缓冲溶液(0.1 mol/L Na2EDTA + 0.1 mol/L Na2HPO4 + 0.06 mol/L柠檬酸,pH = 4.00),涡旋1 min,500 w超声15 min,在4 000 r/min转速下离心10 min;进行反复提取3次的操作后,分别收集土壤上层提取液,为将甲醇浓度控制在10% 以下,需用超纯水稀释提取液至75 ml;以1 ml/min的流速将稀释后的提取液通过HLB柱,提取液全部过柱后继续抽真空20 min,用6 ml甲醇洗脱,使用旋转蒸发仪将洗脱液浓缩到近干,用甲醇-水溶液(体积比为8:2)定容至0.5 ml,样品过0.22 μm滤膜后使用HPLC-MS- MS检测3种目标抗生素的浓度。磺胺嘧啶和磺胺二甲基嘧啶的校准曲线线性范围均为1 ~ 500 μg/L(R2≥0.999 8),检出限为0.1 μg/L。
1.5 数据分析 1.5.1 吸附模型拟合本研究对两种抗生素的等温吸附数据分别用Freundlich模型(式1)、Langmuir模型(式2)、线性模型(式3)3种典型的等温吸附模型进行定量描述。
| $ \lg Q_{\mathrm{e}}=\lg K_{\mathrm{f}}+\frac{1}{n} \lg C_{\mathrm{e}} $ | (1) |
| $ 1 / Q_{\mathrm{e}}=1 / Q_{\mathrm{m}}+1 /\left(K_{\mathrm{L}} Q_{\mathrm{m}} C_{\mathrm{e}}\right) $ | (2) |
| $ \lg K_{\mathrm{d}}=\lg \left(Q_{\mathrm{e}} / C_{\mathrm{e}}\right) $ | (3) |
式中:Qe为平衡吸附量(mg/kg),Ce为平衡溶液中的抗生素浓度(mg/L),Kf为Freundlich吸附容量常数,1/n反映吸附的非线性程度及机理差异;Langmuir吸附系数KL是表征吸附表面强度的常数,Qm为抗生素单分子层吸附时的最大吸附量(mg/kg);Kd为线性吸附模型的固液两相分配系数(L/kg)。
1.5.2 荧光光谱参数计算腐殖化指数(HIX)为255 nm激发波长下,435 ~ 480 nm发射波长处荧光强度积分值和300 ~ 345 nm荧光积分值之比。HIX值越高,说明DOM腐殖化程度越高[14]。
自生源指数(BIX)为310 nm激发波长下380 nm与430 nm的发射波长处荧光强度的比值,用于DOM溯源及自生贡献比例的估算[15-16]。
类腐殖质浓度水平Fn(355)采用355 nm激发波长下发射波长在440 ~ 470 nm之间的荧光强度最大值。类腐殖质浓度水平越大,表示类腐殖质含量越高[17]。
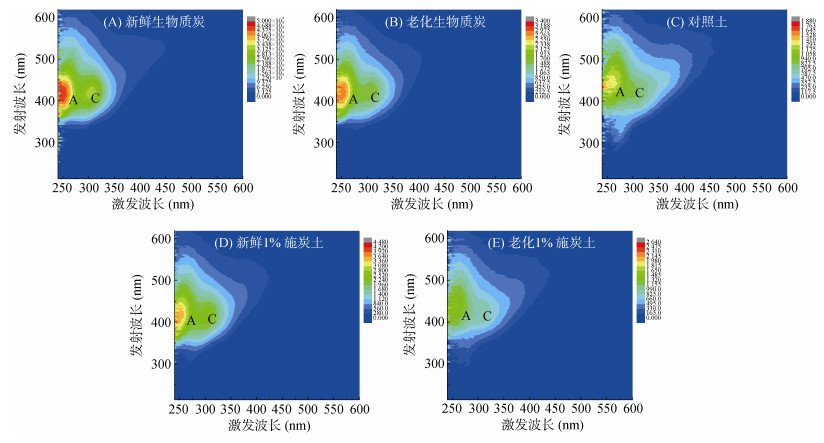
2 结果与讨论 2.1 供试生物质炭及土壤DOM的三维荧光光谱特征新鲜与老化生物质炭以及3种供试土壤批量吸附试验平衡溶液的DOM三维荧光光谱如图 1所示。荧光峰A (Ex /Em =220 ~ 250/380 ~ 480 nm)为紫外光区类富里酸峰,荧光峰C (Ex /Em =260 ~ 360/380 ~ 480 nm)为可见光区类富里酸峰。由图 1可见,施加生物质炭改变了土壤中DOM组分A和C的含量,荧光强度明显增强,组分A和C共同组成类腐殖质组分,被认为是和土壤富里酸结构相似的酚类物质和其他芳香性物质,在其他原料生物质炭如锯末生物质炭DOM中也被检测到[18-19]。结合表 3数据,可看出生物质炭本身含有可溶出的DOM类腐殖质组分,具有较强的荧光响应。新鲜生物质炭的荧光强度显著大于老化生物质炭,这是因为生物质炭在制备过程中未完全炭化,往往含有丰富的易流失物质[20]。施用新鲜生物质炭导致土壤DOM的腐殖化指数和类腐殖质浓度水平升高,这可归因于生物质炭所引入的DOM类腐殖质组分。施用到田间的生物质炭经过3 a干湿交替老化后,其不稳定有机质组分发生淋失。因此,老化1% 施炭土DOM的荧光强度(腐殖化指数、类腐殖质浓度)明显小于新鲜1% 施炭土。
|
图 1 生物质炭与土壤中DOM的三维激发-发射荧光光谱 Fig. 1 EEM fluorescence spectra of dissolved organic matter in the biochars and soils of different treatments |
|
|
表 3 生物质炭与各处理土壤中DOM的荧光特征参数 Table 3 Fluorescence spectra parameters of biochar and soils of different treatments |
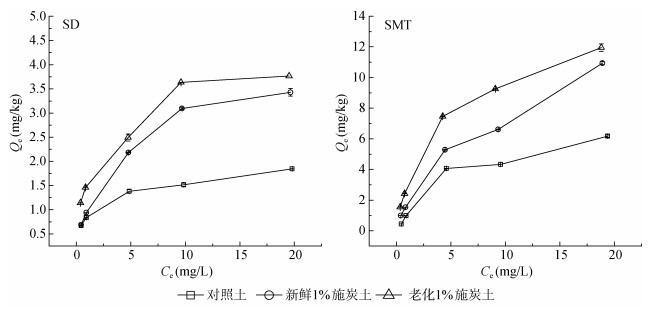
抗生素在不同供试土壤中的等温吸附特征如图 2所示,采用方程拟合,获得了磺胺嘧啶和磺胺二甲基嘧啶在紫色土中的吸附模型参数(表 4),结果发现:对于不同供试土壤,Freundlich方程及Langmuir方程均可良好地模拟吸附的结果,平均拟合决定系数R2分别为0.970和0.963,达到了极显著相关,而线性方程拟合结果的平均R2值仅为0.856;Freundlich方程拟合结果的1/n均小于1,等温吸附线都呈“L型”。
|
图 2 不同处理土壤中抗生素的等温吸附线 Fig. 2 Sorption isotherms of antibiotics in the soils with different treatments |
|
|
表 4 供试土壤中抗生素等温吸附方程的拟合结果 Table 4 Fitted parameters of equations to the adsorption isotherm data of the target antibiotics in the tested soils |
磺胺类抗生素在不同的pH条件下以不同的形态存在,其吸附受形态影响较大,一般以阳离子形态的吸附最强,其次为中性分子形态,最差为阴离子形态[21]。对照土与新鲜1% 施炭土批量吸附平衡溶液的pH较为接近,分别为7.19和7.15。对于这两种土壤,批量平衡溶液中的磺胺嘧啶都主要以阴离子存在,仅有很小比例以中性分子存在;而磺胺二甲基嘧啶大部分以中性分子存在,小部分以阴离子存在。中性分子形态的磺胺二甲基嘧啶主要通过疏水性分配作用吸附于土壤有机质或生物质炭,而少部分阴离子形态的磺胺二甲基嘧啶和主要为阴离子形态的磺胺嘧啶则因与带负电的固相颗粒表面之间存在静电斥力,故而吸附量往往相对较小[22]。施用1% 新鲜生物质炭后,供试石灰性紫色土pH并未发生明显变化(表 2),因而抗生素吸附Kf值的提高可能主要是抗生素向生物质炭疏水分配的结果,且磺胺二甲基嘧啶Kf值的提高幅度高于磺胺嘧啶。1% 施炭土中的生物质炭经过3 a老化后,BET比表面积(由6.35 m2/g升至6.60 m2/g)和微孔容积(由0.004 7 cm3/g增至0.006 2 cm3/g)都仅有小幅提高,而老化后1% 施炭土的pH由新鲜施用时的7.73提高到8.12,其机理尚不明晰。类似地,老化1% 施炭土的批量吸附平衡溶液pH(7.84)也高于新鲜1% 施炭土。这两种磺胺类抗生素在老化1% 施炭土的批量平衡溶液中都主要以中性分子存在,通过疏水分配作用发生吸附。因此,老化1% 施炭土的抗生素吸附容量常数(Kf)明显高于新鲜1% 施炭土,老化对磺胺二甲基嘧啶(pKa, 2值较高)吸附的提高幅度大于磺胺嘧啶(pKa, 2值较低)。此外,依据现有文献[22-25]报导,老化所导致的生物质炭理化性质变化及DOM流失对土壤中抗生素吸附容量的综合影响因土壤、生物质炭和抗生素的种类而异,目前对于土壤/生物炭-DOM-抗生素相互作用尚缺乏统一、系统性的机理认识。
2.3 添加生物质炭对土柱出流液基本化学指标的影响填装土柱试验出流液中pH、EC和DOC浓度的变化曲线如图 3所示(前5个PV为抗生素溶液注入阶段,后5个PV为背景溶液注入阶段)。不同土壤的土柱出流液pH差异不大,且随PV数的增加无明显变化。新鲜1% 施炭土的填装柱出流液EC始终高于其他两种土壤,总体呈下降趋势,主要是新鲜生物质炭本身所含的大量盐基离子洗脱所致。类似地,Bagreev等[26]发现生物质炭在老化过程中Zn、Mn含量随着生物质炭的老化逐渐下降,其他一些碱性元素的含量也不同程度地下降。对于对照土和老化1% 施炭土而言,所观测到的高EC值平台主要由5个PV抗生素溶液中所含的示踪剂KBr所致。3种土壤的填装柱出流液中DOC浓度整体均随着PV数的增加而减小并逐渐趋于稳定,平衡浓度的大小表现为:新鲜1% 施炭土 > 对照土 > 老化1% 施炭土,这与批量吸附试验中荧光强度的结果是一致的,以新鲜施炭土中DOC溶出与迁移量最高,可能主要来源于生物质炭所含的不稳定有机质。
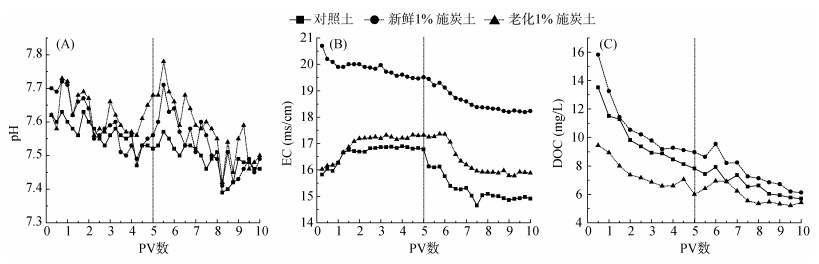
|
图 3 填装土柱出流液pH、EC和DOC浓度变化曲线 Fig. 3 Variations of pH、EC and DOC concentration in the effluents of repacked soil columns |
土柱迁移试验是评价污染物的环境安全性与污染风险的重要手段。穿透曲线是土柱出流液溶质相对浓度(C/C0)和孔隙体积(PV)的关系曲线,其相对平衡浓度(峰值)主要反映土壤对抗生素吸附作用的强弱,结果如图 4所示。
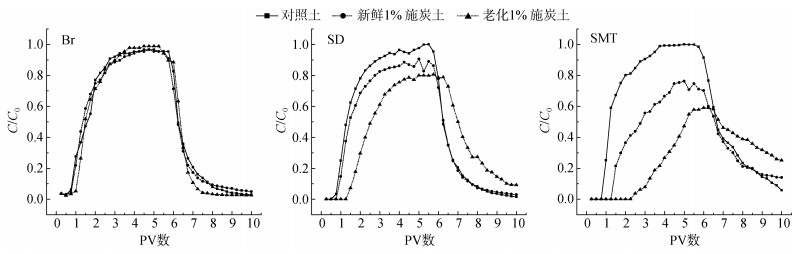
|
图 4 填装土柱中的Br-和抗生素穿透曲线 Fig. 4 Breakthrough curves of Br- and sulfonamide antibiotics in repacked soil columns |
对照土填装柱出流液中磺胺类抗生素的相对平衡浓度(峰值)与Br-示踪剂(示踪水分运动的非反应性溶质)相近,但抗生素达到峰值浓度所需时间延迟,穿透曲线呈现不对称和“拖尾”特征,存在吸附截留和解吸延滞现象;磺胺二甲基嘧啶比磺胺嘧啶的穿透延迟(更晚)和“拖尾”(浓度更高)现象更为显著。就土柱穿透曲线的相对平衡浓度而言,两种抗生素均表现为:老化1% 施炭土 < 新鲜1% 施炭土 < 对照土,说明在本土柱试验流量条件下,生物质炭添加起到了增强吸附、削减抗生素淋出峰值浓度的作用,且这种作用在老化后变得更强。生物质炭添加对磺胺二甲基嘧啶峰值浓度的削减幅度(在对照土、新鲜1% 施炭土和老化1% 施炭土的相对平衡浓度中分别约为100%、76% 和59%)大于磺胺嘧啶(在对照土、新鲜1% 施炭土和老化1% 施炭土中的相对平衡浓度分别约为100%、91% 和81%)。这些土柱穿透试验结果与批量吸附试验结果是相符的,抗生素吸附Kf值越高的土壤,其填装柱出流液的抗生素平衡浓度越低。Jeong等[27]通过对比添加(质量比5% 经室内干湿交替培养5周)和不添加硬木生物质炭的易混合置换土柱试验结果发现,在林地和玉米地土壤中施用生物质炭后,填装柱出流液的泰勒菌素相对浓度峰值减小且出现时间延迟,穿透曲线的形状由对称变为非对称并出现长拖尾。
2.5 生物质炭添加对土柱中抗生素垂直分布的影响土柱穿透试验结束后,磺胺嘧啶和磺胺二甲基嘧啶在3种处理土壤填装柱的不同深度土层中的含量分布特征如图 5所示。对照土填装柱的磺胺嘧啶和磺胺二甲基嘧啶残留总量分别仅占投加总量的1.52% 和1.47%,说明这两种磺胺类抗生素在紫色土中容易发生高通量淋失,可能迁移至深层土壤甚至地下水。新鲜添加1% 生物质炭使土壤中磺胺嘧啶和磺胺二甲基嘧啶的残留总量分别提高至投加总量的4.63% 和8.39%;经3 a老化后,分别进一步提高到投加量的11.50% 和27.02%。由此可见,生物质炭的添加可以有效吸附抗生素,将抗生素截留“锁定”在土壤中,而且经3 a田间老化后1% 施炭土能将更多的抗生素固定于土壤中,从而减少抗生素的迁移,降低其对生态环境的风险。
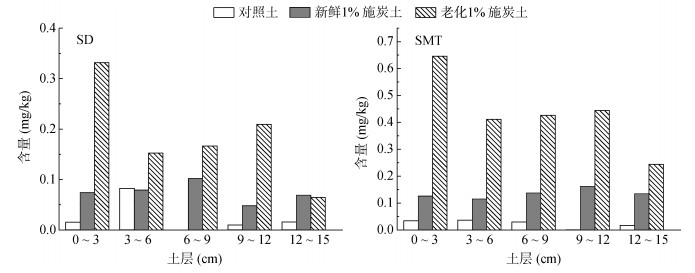
|
图 5 土柱中抗生素含量的垂直分布特征 Fig. 5 Vertical distribution characteristics of antibiotic content in soil column |
由抗生素的吸附试验和填装土柱迁移试验结果可见,3 a老化1% 施炭土对磺胺类抗生素的吸附固定和迁移阻滞能力强于新鲜1% 施炭土。有研究表明,老化过程使生物质炭表面有机物消除,微孔数增加,微孔结构逐渐发育是关键因素之一[28];生物质炭在长期老化的过程中其表面会产生羟基(-OH)和羧基(-COOH)等含氧官能团[29],这些官能团可与抗生素中的羰基(C=O)上的氧原子形成氢键,导致吸附量增加[30];低浓度DOM能通过与抗生素在土壤上发生共吸附,而高浓度DOM却可能具有增溶作用,促进抗生素从土壤中解吸[31]。在本研究中,生物质炭的投加量仅为1%,老化3 a后比表面积仅有小幅增加,3种土壤的填装柱出流液pH介于7.46 ~ 7.77。磺胺嘧啶主要为阴离子形态(不易为土壤所吸附);磺胺二甲基嘧啶大部分为阴离子,小部分为中性分子形态(易疏水分配至颗粒有机质中)。土柱试验中DOM淋失浓度以老化1% 施炭土最低,新鲜1% 施炭土次之,对照土最高。可以推论,对于老化1% 施炭土而言,生物质炭中大部分可溶有机质组分经田间老化过程中已淋失[32],增溶作用基本消失。磺胺二甲基嘧啶主要以中性分子形态疏水分配到生物质炭的难溶有机质组分中;而在新鲜1% 施炭土中有一部分磺胺二甲基嘧啶被生物质炭源DOM助溶或竞争颗粒吸附位点,故而抗生素在新鲜1% 施炭土填装柱中的穿透峰值浓度高于在老化1%施炭土填装柱中。相比而言,主要以阴离子形态存在的磺胺嘧啶在不同土壤填装柱中的穿透峰值浓度的差异相对较小,生物质炭削减其穿透峰值的能力相对较弱。
3 结论1) Freundlich方程和Langmuir方程均能比线性模型更好地拟合磺胺嘧啶和磺胺二甲基嘧啶在石灰性紫色土对照土、新鲜和老化1% 施炭土中的等温吸附曲线。
2) 在批量平衡吸附试验体系中,新鲜施用1% 生物质炭能显著提高土壤对磺胺嘧啶和磺胺二甲基嘧啶的吸附能力;经3 a田间老化后,抗生素吸附能力进一步得以提高,可归因于土壤pH的提高。
3) 在填装土柱试验体系中,磺胺嘧啶和磺胺二甲基嘧啶表现出很强的迁移淋失能力,添加1% 生物质炭可降低抗生素穿透峰值浓度,田间老化可进一步提高其峰值削减幅度,且以对磺胺二甲基嘧啶的效果相对较好。
| [1] |
Brandt K K, Amézquita A, Backhaus T, et al. Ecotoxicological assessment of antibiotics: a call for improved consideration of microorganisms[J]. Environment International, 2015, 85: 189-205 DOI:10.1016/j.envint.2015.09.013 (  0) 0) |
| [2] |
Zhu Y G, Johnson T A, Su J Q, et al. Diverse and abundant antibiotic resistance genes in Chinese swine farms[J]. Proceedings of the National Academy of Sciences of the United States of America, 2013, 110(9): 3435-3440 DOI:10.1073/pnas.1222743110 (  0) 0) |
| [3] |
Du L F, Liu W K. Occurrence, fate, and ecotoxicity of antibiotics in agro-ecosystems. A review[J]. Agronomy for Sustainable Development, 2012, 32(2): 309-327 DOI:10.1007/s13593-011-0062-9 (  0) 0) |
| [4] |
刘潇雅, 徐源洲, 贺南南, 等. 土壤磺胺类抗生素固相萃取-高效液相色谱法的构建与优化[J]. 土壤, 2019, 51(6): 1129-1136 (  0) 0) |
| [5] |
邵珍珍, 林青, 徐绍辉. 不同离子强度下SiO2胶体对磺胺嘧啶土壤吸附迁移行为的影响[J]. 土壤学报, 2018, 55(2): 411-421 (  0) 0) |
| [6] |
Yuan J H, Xu R K. The amelioration effects of low temperature biochar generated from nine crop residues on an acidic Ultisol[J]. Soil Use and Management, 2011, 27(1): 110-115 DOI:10.1111/j.1475-2743.2010.00317.x (  0) 0) |
| [7] |
张萌, 魏全全, 肖厚军, 等. 生物质炭对贵州黄壤朝天椒减氮的生物效应及氮肥利用率的影响[J]. 土壤学报, 2019, 56(5): 1201-1209 (  0) 0) |
| [8] |
Cao X D, Ma L N, Gao B, et al. Dairy-manure derived biochar effectively sorbs lead and atrazine[J]. Environmental Science & Technology, 2009, 43(9): 3285-3291 (  0) 0) |
| [9] |
阴文敏, 关卓, 刘琛, 等. 生物炭施用及老化对紫色土中抗生素吸附特征的影响[J]. 环境科学, 2019, 40(6): 2920-2929 (  0) 0) |
| [10] |
卿敬, 张建强, 关卓, 等. 农田土壤中生物质炭的老化及其对有机污染物吸附-解吸影响的研究进展[J]. 土壤, 2017, 49(5): 859-867 (  0) 0) |
| [11] |
王畅, 李余杰, 张智, 等. 氟喹诺酮类抗生素在农业紫色土中的吸附研究[J]. 土壤, 2018, 50(5): 958-964 (  0) 0) |
| [12] |
鲜青松, 唐翔宇, 朱波. 坡耕地薄层紫色土-岩石系统中氮磷的迁移特征[J]. 环境科学, 2017, 38(7): 2843-2849 (  0) 0) |
| [13] |
任美, 唐翔宇, 耿春女, 等. 生物质炭对坡耕地紫色土中抗生素吸附-解吸及迁移的影响[J]. 土壤, 2020, 52(5): 978-986 (  0) 0) |
| [14] |
Ohno T. Fluorescence inner-filtering correction for determining the humification index of dissolved organic matter[J]. Environmental Science & Technology, 2002, 36(4): 742-746 (  0) 0) |
| [15] |
Huguet A, Vacher L, Relexans S, et al. Properties of fluorescent dissolved organic matter in the Gironde Estuary[J]. Organic Geochemistry, 2009, 40(6): 706-719 DOI:10.1016/j.orggeochem.2009.03.002 (  0) 0) |
| [16] |
陈俊伊, 王书航, 姜霞, 等. 蠡湖表层沉积物荧光溶解性有机质(FDOM)荧光光谱特征[J]. 环境科学, 2017, 38(1): 70-77 (  0) 0) |
| [17] |
范诗雨, 秦纪洪, 刘堰杨, 等. 岷江上游水体中DOM光谱特征的季节变化[J]. 环境科学, 2018, 39(10): 4530-4538 (  0) 0) |
| [18] |
Uchimiya M, Ohno T, He Z Q. Pyrolysis temperature-dependent release of dissolved organic carbon from plant, manure, and biorefinery wastes[J]. Journal of Analytical and Applied Pyrolysis, 2013, 104: 84-94 DOI:10.1016/j.jaap.2013.09.003 (  0) 0) |
| [19] |
Jamieson T, Sager E, Guéguen C. Characterization of biochar-derived dissolved organic matter using UV-visible absorption and excitation-emission fluorescence spectroscopies[J]. Chemosphere, 2014, 103: 197-204 DOI:10.1016/j.chemosphere.2013.11.066 (  0) 0) |
| [20] |
Laird D A, Fleming P, Davis D D, et al. Impact of biochar amendments on the quality of a typical Midwestern agricultural soil[J]. Geoderma, 2010, 158(3/4): 443-449 (  0) 0) |
| [21] |
孔晶晶, 裴志国, 温蓓, 等. 磺胺嘧啶和磺胺噻唑在土壤中的吸附行为[J]. 环境化学, 2008, 27(6): 736-741 DOI:10.3321/j.issn:0254-6108.2008.06.007 (  0) 0) |
| [22] |
Tolls J. Sorption of veterinary pharmaceuticals in soils: a review[J]. Environmental Science & Technology, 2001, 35(17): 3397-3406 (  0) 0) |
| [23] |
Kulshrestha P, Giese R F, Aga D S. Investigating the molecular interactions of oxytetracycline in clay and organic matter: insights on factors affecting its mobility in soil[J]. Environmental Science & Technology, 2004, 38(15): 4097-4105 (  0) 0) |
| [24] |
Ren X H, Sun H W, Wang F, et al. Effect of aging in field soil on biochar's properties and its sorption capacity[J]. Environmental Pollution, 2018, 242: 1880-1886 DOI:10.1016/j.envpol.2018.07.078 (  0) 0) |
| [25] |
He Y, Liu C, Tang X Y, et al. Biochar impacts on sorption-desorption of oxytetracycline and florfenicol in an alkaline farmland soil as affected by field ageing[J]. Science of the Total Environment, 2019, 671: 928-936 DOI:10.1016/j.scitotenv.2019.03.414 (  0) 0) |
| [26] |
Bagreev A, Bandosz T J, Locke D C. Pore structure and surface chemistry of adsorbents obtained by pyrolysis of sewage sludge-derived fertilizer[J]. Carbon, 2001, 39(13): 1971-1979 DOI:10.1016/S0008-6223(01)00026-4 (  0) 0) |
| [27] |
Jeong C Y, Wang J J, Dodla S K, et al. Effect of biochar amendment on tylosin adsorption-desorption and transport in two different soils[J]. Journal of Environmental Quality, 2012, 41(4): 1185-1192 DOI:10.2134/jeq2011.0166 (  0) 0) |
| [28] |
Trigo C, Spokas K A, Cox L, et al. Influence of soil biochar aging on sorption of the herbicides MCPA, nicosulfuron, terbuthylazine, indaziflam, and fluoroethyldiaminotriazine[J]. Journal of Agricultural and Food Chemistry, 2014, 62(45): 10855-10860 DOI:10.1021/jf5034398 (  0) 0) |
| [29] |
Joseph S D, Camps-Arbestain M, Lin Y, et al. An investigation into the reactions of biochar in soil[J]. Soil Research, 2010, 48(7): 501 DOI:10.1071/SR10009 (  0) 0) |
| [30] |
刘玉芳. 四环素类抗生素在土壤中的迁移转化模拟研究[D]. 广州: 暨南大学, 2012.
(  0) 0) |
| [31] |
Kulshrestha P, Giese R F, Aga D S. Investigating the molecular interactions of oxytetracycline in clay and organic matter: insights on factors affecting its mobility in soil[J]. Environmental Science & Technology, 2004, 38(15): 4097-4105 (  0) 0) |
| [32] |
Mukherjee A, Zimmerman A R. Organic carbon and nutrient release from a range of laboratory-produced biochars and biochar-soil mixtures[J]. Geoderma, 2013, 193/194: 122-130 DOI:10.1016/j.geoderma.2012.10.002 (  0) 0) |
2. Institute of Mountain Hazards and Environment, Chinese Academy of Sciences, Chengdu 610041, China
 2021, Vol. 53
2021, Vol. 53