红壤坡耕地是南方红壤区发展农业多种经营、优化农业产业结构的重要土壤资源,也是红壤区水土流失的主要策源地[1]。近年来,受自然和人为等因素的影响,该区水土流失问题还没有得到有效的解决,土壤有机质含量降低,农业生态系统脆弱,严重制约了区域农业的可持续发展[2]。等高植物篱、秸秆覆盖等生物水土保持措施(生物水保措施)在控制坡耕地水土流失、提高土壤养分、改善土壤团粒结构等方面效果显著[3-6],业已成为恢复重建南方退化红壤肥力和生态功能的有效措施之一[7]。土壤微生物在土壤有机质形成与分解、氮素循环与转化以及提升生态系统生产力等生态过程中发挥重要作用,是土壤质量和生态系统稳定健康的重要指标[8-9]。
近年来,有关秸秆覆盖和植物篱等生物水保措施对土壤微生物群落结构多样性影响的研究越来越受到关注[10-12]。秸秆覆盖和植物篱通过外源有机物质的投入直接或者通过拦截降雨、减少冲蚀进而优化土壤结构、提升土壤肥力间接为土壤微生物繁殖和生长提供养料和水热条件[6],从而有利于增加微生物活性与多样性。也有研究表明,香根草篱和稻草覆盖通过直接投入凋落物、根系等带入了大量的高碳氮比(C/N)有机物料,其分解过程加剧了微生物和植物之间的养分竞争[13],加之两种措施不同水保机制造成土壤养分、有机碳的种类和数量不同,由此导致不同生物水保措施间土壤微生物总量和群落组成及比例各异[14-15]。
细菌是土壤微生物的重要组成部分,土壤中细菌的数量丰富且种类繁多,其多样性和丰度对其所生存微环境状况较敏感,如土壤有效养分、土壤有机质特性及地表植被状况等[16]。目前,关于生物水保措施与土壤微生物特性的关系研究主要有植物篱有无、植物篱种类、秸秆覆盖量对土壤微生物三大主要类群总量、酶活性及微生物生物量碳、氮等特性的影响[17],而对草篱和覆盖等不同生物水保措施对土壤细菌群落组成影响的研究相对较少[11, 15],对不同措施引起细菌群落变化的主控环境因子也并不十分清楚。因此,本文以红壤坡耕地不同生物水保措施的长期定位试验为平台,通过高通量测序技术,研究香根草篱和稻草覆盖对土壤细菌群落结构和组成的影响,分析土壤细菌菌群与环境因子的相关关系,明确影响土壤细菌组成的主控环境因子,为筛选更利于红壤坡耕地水土流失防治、培育及提高红壤坡耕地土壤生物肥力及调整当地的农业经营管理模式提供参考。
1 材料与方法 1.1 试验区概况试验区位于江西省红壤研究所水土保持试验站(116°20′24″ E,28°15′30″ N)。该区为典型的低丘红壤区,属于中亚热带季风气候,年均降水量1 537 mm,降水丰富但季节分配不均,年均气温17.7 ~ 18.5℃。供试土壤为第四纪红黏土母质发育的红壤,试验前土壤基本理化性质为:pH(H2O)5.0,有机质16.2 g/kg,全氮1.93 g/kg,全磷0.66 g/kg,全钾1.39 g/kg。
1.2 试验设计定位试验始于2009年,试验设置花生常规等高种植(CK),以及在常规等高种植的基础上配合香根草篱(H)、稻草覆盖(M)、香根草篱+稻草覆盖(HM)3个水保措施处理,小区面积120 m2 (24 m × 5 m),3次重复,完全随机排列。样地坡度10°,供试花生品种为粤油991,种植密度为32 cm × 20 cm。香根草(Vetiveria zizanioides)篱每隔8 m双行种植,株行距为50 cm × 50 cm;覆盖稻草处理在花生播种后每个小区均匀覆盖干稻草4 500 kg/hm2,试验期间(4-8月)覆盖稻草腐解率为60% ~ 70%。
香根草是一种直立型多年生草本植物,根系纵深可生长至2 ~ 3 m。本团队前期通过香根草篱对间作花生产量的空间影响距离的研究发现,栽种香根草篱能显著增加距离其1.65 ~ 2.97 m范围花生的产量,但却降低距离其1.0 m内花生的产量[18]。为了减少香根草篱过高遮阴对花生生长造成的不利效果,试验期间确保香根草定期刈割至30 ~ 50 cm。
试验区播种前施三元复合肥(N-P2O5-K2O: 15- 15-15)416.7 kg/hm2,钙镁磷肥(CaO≥180 g/kg,MgO≥30 g/kg,P2O5≥120 g/kg)525 kg/hm2。各处理花生种植方式和农事操作相同[15]。
于2016年9月(花生收获后1个月)在每个香根草篱试验小区的上坡位采集距离篱带上部2 m内0 ~ 15 cm土层土样,无香根草篱小区沿等高线采集相同坡位土样[15]。
1.3 测定指标及方法 1.3.1 土壤基础性质土壤有机碳(TOC)测定采用浓硫酸-重铬酸钾外加热法;土壤可溶性有机碳(DOC)以水土比为4∶1(V/m)振荡30 min后,4 000 r/min离心抽滤后,用有机碳分析仪(岛津TOC- VCPH)测定[19];土壤铵态氮(NH4+-N)和硝态氮(NO3--N)用0.5 mol/L硫酸钾浸提过滤后,用流动注射分析仪(Auto Analyer AA3,德国)测定。
1.3.2 土壤酶活性土壤酶活性测定采用微孔板荧光法[20]。利用荧光物质4-羟甲基-7-香豆素(MUB) 共轭物质作为测定底物,选取α-葡糖苷酶(α-glucosidase,AG)、β-葡糖苷酶(β-glucosidase,BG)、纤维素酶(cellulase,CB)和木聚糖酶(xylanase,XYL) 4种参与碳循环的酶,以及亮氨酸氨基肽酶(leucine aminopeptidase,LAP)、N-乙酰基-β-D氨基葡萄糖苷酶(N-acetyl-β-D-glucosaminidase,NAG)2种参与氮循环的酶测定。用每小时每克样品的基质转化率表示样品酶活性(nmol/(g·h))。
1.3.3 土壤DNA提取和高通量测序采用Soil DNA Kit试剂盒(OMEGA公司,美国)进行土壤DNA的提取。细菌样品测序引物是515F/907R,引物序列为515F (5-GTGCCAGCMGCCGCGG-3),907R(5-CC GTCAATTCMTTRAGTTT-3),测序区域为V4 ~ V5[21]。土壤微生物总DNA提取和测序服务委托上海派森诺生物科技有限公司完成。
1.4 数据处理与统计分析首先对有效序列进行去杂和修剪得到优化数据,在97%的相似水平上使用UPARSE算法进行OTU聚类,使用Uchime去除嵌合体,使用Silva等数据库进行物种分类信息的划分。利用软件Mothur计算得到Chao1、Shannon指数。单样本的多样性分析(Alpha多样性)可以反映细菌群落的丰度和多样性,通过Chao1指数分析样品中细菌群落的丰富度,Shannon指数分析样品中细菌群落的多样性。利用R语言生成样本间(或组间)OTU的维恩(Veen)图以及主成分分析(PCA)和典范对应分析(CCA),并根据OTU表的结果,得到样品的丰富度以及各个样品的物种组成比例情况[21-22]。
试验数据通过SPSS 17.0进行单因素方差分析(one-way ANOVA)和相关分析,多重比较选择Duncan极值法,显著性水平为P < 0.05。绘图采用Origin 8.0软件。为保证结果可靠性,减少误差,仅分析相对丰度高于1%的细菌类群。
2 结果与分析 2.1 不同水保措施下土壤细菌丰富度和Alpha多样性不同处理土壤细菌的OTUs丰富度和Alpha多样性见表 1。从表 1可以看出,与对照(CK)相比,香根草篱(H)处理细菌的丰富度、Chao1和Shannon多样性指数均无明显差异,有稻草覆盖的处理(M和HM)显著增加了细菌的丰富度和Shannon多样性指数,其中HM处理对细菌丰富度的增加幅度显著高于M处理。双因素方差分析结果显示(表 1),香根草篱和稻草覆盖均是增加土壤细菌丰富度的影响因素,而稻草覆盖是增加土壤细菌多样性的主要影响因素。
|
|
表 1 不同水保措施下土壤细菌丰富度和多样性指数 Table 1 OTU richness and Chao1 and Shannon indexes under different soil and water conservation measures |
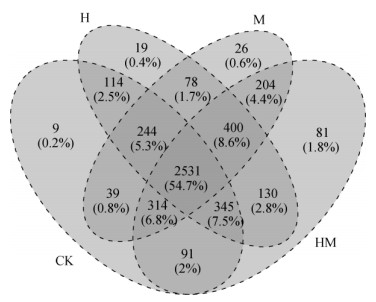
韦恩图用于统计分析不同生物水保措施中共有或独有微生物数目,可以直观反映不同水保措施之间微生物群落组成相似程度。图 1列出了各处理OTUs组成的重叠情况,数字表示所在区域的OTU数目,结果显示,CK处理和H、M、HM三种水保措施处理之间共有细菌种类2 531种,H、M和HM处理之间共有细菌种类400种。H、M和HM处理土壤细菌特有种的数量均显著高于CK处理(9个),HM处理特有种81种(占总体的1.8%) 显著高于H处理特有种19种(占总体的0.4%) 和M处理特有种26种(占总体的0.6%) (图 1)。
|
图 1 不同水保措施下细菌组成差异 Fig. 1 Differences in bacterial compositions under different soil and water conservation measures |
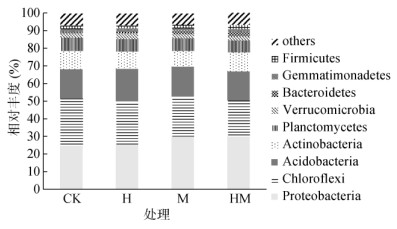
从门的分类水平看(图 2),变形菌门(Proteobacteria,27.4% ~ 30.2%)、绿弯菌门(Chloroflexi,20.2% ~ 26.8%)、酸杆菌门(Acidobacteria,16.8% ~ 18.3%)、放线菌门(Actinobacteria,8.8% ~ 10.6%)和浮霉菌门(Planctomycetes,7.1% ~ 7.6%)等9个门类是所有处理中的优势菌群,其相对丰度之和约占土壤细菌总量的90%,非优势细菌包括厚壁菌门(Firmicutes)和拟杆菌门(Bacteroidetes)。与CK处理相比,M和HM处理分别显著增加了变形菌门的相对丰度5.1%和5.4%(P < 0.05),降低了绿弯菌门的相对丰度,HM处理还显著增加了拟杆菌门的相对丰度1.2%。相比CK处理,H处理增加了酸杆菌门相对丰度,而M处理降低了放线菌门相对丰度,但差异均未达显著水平(P > 0.05)。
|
图 2 不同水保措施下土壤细菌门水平的相对丰度 Fig. 2 Relative abundances of bacteria at phyla level under differnenrt soil and water conservation measures |
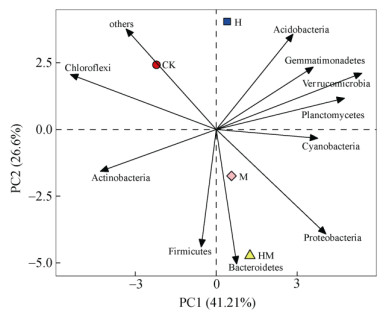
主成分分析结果表明(图 3),第一、二主成分贡献率分别为41.21% 和26.60%。CK处理投射点分布在第二象限,H处理投射点分布在第一象限,M和HM处理投射点分布在第四象限,说明不同水保措施下土壤细菌组成结构有较明显分异,具体而言,有水保措施与无水保措施差异较大,即使有水保措施,有稻草覆盖处理的M和HM处理土壤细菌群落结构相近,但与H处理的细菌群落结构不同。
|
图 3 不同水保措施下土壤细菌群落结构主成分分析 Fig. 3 Principal component analysis (PCA) of bacterial community structures under different soil and water conservation measures |
与CK处理相比,M和HM处理土壤总有机碳含量分别显著增加8.6% 和26.1%,但不同措施下土壤可溶性有机碳含量与CK处理相比无明显差异。相比CK处理,H和M处理均显著降低了土壤铵态氮含量,而H处理显著增加了土壤硝态氮含量(表 3)。
|
|
表 3 不同水保措施对土壤总有机碳、可溶性有机碳、铵态氮和硝态氮的影响 Table 3 Contents of soil total organic carbon, dissolved organic carbon, NH4+-N and NO- 3-N under different soil and water conservation measures |
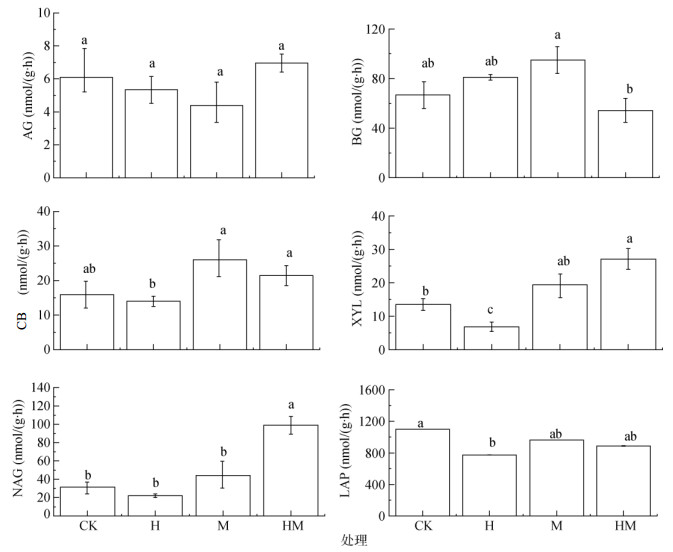
H和M处理对参与碳循环的酶(AG、BG、CB和XYL)和氮循环的酶(LAP和NAG)活性的影响各异(图 4)。相比CK处理,H处理显著降低了土壤XYL和LAP活性,但对其他酶活性无显著影响;M和HM处理主要增加了BG、CB、XYL和NAG活性,HM处理显著增加了土壤XYL和NAG活性,分别是CK处理的2.0倍和4.5倍。
|
(α-葡糖苷酶:AG;β-葡糖苷酶:BG;纤维素酶:CB;木聚糖酶:XYL;亮氨酸氨基肽酶:LAP;N-乙酰基-β-D氨基葡萄糖苷酶:NAG;图中不同小写字母表示不同处理间差异在P < 0.05水平显著) 图 4 不同水保措施对AG、GB、CB、XYL、LAP及NAG活性的影响 Fig. 4 Activities of AG、GB、CB、XYL、LAP and NAG under different soil and water conservation measures |
为进一步探讨稻草覆盖、香根草篱和二者结合措施土壤中细菌群落结构分布与土壤环境因子的关系,将每个水保措施中细菌结构组成与相应环境因子进行典范对应分析。结果表明,土壤总有机碳含量、XYL活性、硝态氮含量和NAG活性与土壤细菌群落组成分布有显著的相关性(图 5和表 4)。同时H、M和HM三种水保措施对细菌群落结构分布也有显著影响(F=4.900,P=0.028) (图 5)。

|
(变形菌门:Proteobacteria;绿弯菌门:Chloroflexi;酸杆菌门:Acidobacteria;放线菌门:Actinobacteria;浮霉菌门:Planctomycetes;厚壁菌门:Firmicutes;拟杆菌门:Bacteroidetes;芽単胞菌门:Gemmatimonadetes;疣微菌门:Verrucomicrobia) 图 5 门水平细菌群落与土壤环境因子的典范对应分析图 Fig. 5 Canonical correspondence analysis (CCA) biplots representing relationships between soil environmental factors and bacterial community at phyla level |
|
|
表 4 土壤环境因子对细菌群落组成影响的显著性分析 Table 4 Significant effects of soil physicochemical parameters on bacterial community composition |
香根草篱和稻草覆盖通过作物根系及其分泌物、根系残茬以及外源碳投入等提高土壤肥力、改善土壤结构,为土壤微生物提供了大量碳源与营养元素[15],促进土壤微生物繁殖,增加微生物生物量[11]。因此,相比常规等高种植,有香根草篱和稻草覆盖处理土壤的细菌丰富度和多样性指数相对较高,这和前人的大量研究结果相似[23]。
土壤细菌是生态过程的重要参与者,土壤养分、水分和结构等环境条件直接影响细菌群落的组成和多样性,因此能够改变土壤理化性质的管理措施,也将会引起细菌群落结构和多样性发生改变[24-25]。香根草篱和稻草覆盖处理不同的凋落物组成和根系分泌物向土壤中输入的碳源、氮源的种类和数量不同,以及两种措施水保机制的不同导致其影响下的土壤养分及结构各异[15],进而导致土壤中适宜细菌的组成和多样性也略有差异(表 1和图 1)。研究表明,变形菌门细菌作为一种营养丰富的共生性细菌,多存在于土壤有机碳含量较高的土壤[26]。本试验中,所有处理土壤变形菌门是优势菌门,香根草篱、稻草覆盖、香根草篱+稻草覆盖3种水保措施均提高了土壤变形菌门的相对丰度,表明短期内外源碳输入增加了土壤中的可利用碳源的有效性,进而影响“富养型”细菌的丰度和活性。然而,不同碳输入方式、种类和土壤理化性质的差异将影响土壤微生物群落组成[27]。文中主成分分析结果表明,香根草篱和稻草覆盖处理土壤细菌群落结构不同,香根草篱的凋落物和根系分泌物中输入碳的种类和数量与覆盖稻草分解输入的碳有差异[15],这可能是导致香根草篱处理土壤变形菌门(Proteobacteria)的相对丰度显著低于稻草覆盖处理的原因。同时,不同的细菌类群在土壤中的功能差异显著。有研究表明,拟杆菌门(Bacteroidetes)具有分解难降解物质转化为有机物的作用[28],而酸杆菌门(Acidobacteria)包括许多寡营养细菌[23]。本研究中,3种水保措施均增加了拟杆菌门的相对丰度,说明外源稻草和香根草篱有机碳的输入有利于拟杆菌门类细菌生长繁殖,且稻草覆盖和香根草篱二者结合处理效果最为显著。香根草篱处理酸杆菌门细菌相对含量增加,说明单独香根草篱处理土壤存在一定的营养胁迫[15],同时草篱根系拦截水土流失后对土壤微生物的保护和活化作用是增加许多寡营养细菌数量的又一原因。然而,细菌群落结构受多种营养限制,与气候条件和土壤其他理化性质都有关系[29],具体原因有待进一步研究。
土壤微生物不仅是土壤养分转化与循环的动力,本身也是土壤养分的储存库。微生物一方面通过调节群落结构组成维持土壤生态平衡;另一方面,微生物通过调控与土壤物质循环密切相关酶的分泌来加速养分溶解或增加对限制性养分的吸收[30-31]。本试验中,稻草覆盖和香根草篱处理直接或间接增加了土壤碳含量,刺激微生物活动,从而导致与碳循环有关的BG、CB、XYL活性的增加;而氮素的输入相对不足需要微生物分泌更多的氮循环酶NAG,进而促进有机态氮的矿化[15, 30],维持自身的需要。但与稻草覆盖处理不同的是,香根草篱处理显著降低了土壤XYL和LAP活性,是因为草篱发达的根系代谢会释放大量的酶类及其根际分泌物缓解了土壤养分丰缺状况,而不同水保措施下土壤矿质氮含量的变化,可能是因为不同种类细菌在土壤中的功能不同[32-33],加之土壤-作物系统及其环境方面的异质性影响了氮素循环转化过程及其产物;相反,土壤理化性质也是影响细菌的群落组成的重要因素,CCA分析表明土壤有机碳和XYL、NAG酶活性和硝态氮含量均是影响细菌群落组成的主要因子,但对细菌群落组成的影响与不同水保措施密切相关,不同措施间土壤养分状况差异以及与参与其转化微生物间的相互作用还需进一步研究。本研究中,稻草覆盖与香根草篱+稻草覆盖处理土壤细菌群落结构组成相近,这与前期PLFA研究结果不一致[15],是因为两种方法检测指标以及定量方法不同所致,同时这也说明微生物的功能特征结合群落种群分析对全面了解微生物类群多样性变化至关重要。
4 结论稻草覆盖和香根草篱等生物水保措施均改变了土壤细菌的丰富度和多样性,稻草覆盖、香根草篱及二者结合措施显著增加了土壤细菌特有种的数量,稻草覆盖和香根草篱措施均是增加土壤细菌丰富度的影响因素,而稻草覆盖措施是增加土壤细菌多样性的主要影响因素。有稻草覆盖的处理土壤细菌群落结构相近,与单独香根草篱处理的细菌群落结构不同。本试验条件下土壤XYL和NAG活性与细菌群落结构组成密切相关,土壤有机碳和硝态氮含量是影响细菌群落结构变化的主要环境因子。
| [1] |
赵其国. 我国红壤的退化问题[J]. 土壤, 1995, 27(6): 281-285 (  0) 0) |
| [2] |
梁音, 张斌, 潘贤章, 等. 南方红壤丘陵区水土流失现状与综合治理对策[J]. 中国水土保持科学, 2008, 6(1): 22-27 DOI:10.3969/j.issn.1672-3007.2008.01.004 (  0) 0) |
| [3] |
蒲玉琳, 谢德体, 林超文, 等. 植物篱-农作坡耕地土壤微团聚体组成及分形特征[J]. 土壤学报, 2012, 49(6): 1069-1077 (  0) 0) |
| [4] |
蒲玉琳, 林超文, 谢德体, 等. 植物篱-农作坡地土壤团聚体组成和稳定性特征[J]. 应用生态学报, 2013, 24(1): 122-128 (  0) 0) |
| [5] |
郑海金, 杨洁, 黄鹏飞, 等. 覆盖和草篱对红壤坡耕地花生生长和土壤特性的影响[J]. 农业机械学报, 2016, 47(4): 119-126 (  0) 0) |
| [6] |
成艳红, 武琳, 孙慧娟, 等. 稻草覆盖和香根草篱对红壤水稳性团聚体组成及有机碳含量的影响[J]. 生态学报, 2016, 36(12): 3518-3524 (  0) 0) |
| [7] |
李新平, 王兆骞, 陈欣, 等. 红壤坡耕地人工模拟降雨条件下植物篱笆水土保持效应及机理研究[J]. 水土保持学报, 2002, 16(2): 36-40 DOI:10.3321/j.issn:1009-2242.2002.02.010 (  0) 0) |
| [8] |
Girvan M S, Campbell C D, Killham K, et al. Bacterial diversity promotes community stability and functional resilience after perturbation[J]. Environmental Microbiology, 2005, 7(3): 301-313 DOI:10.1111/j.1462-2920.2005.00695.x (  0) 0) |
| [9] |
杨亚东, 王志敏, 曾昭海. 长期施肥和灌溉对土壤细菌数量、多样性和群落结构的影响[J]. 中国农业科学, 2018, 51(2): 290-301 (  0) 0) |
| [10] |
郭甜, 何丙辉, 蒋先军, 等. 紫色土区植物篱对坡面土壤微生物特性的影响[J]. 水土保持学报, 2011, 25(5): 94-98, 185 (  0) 0) |
| [11] |
王玉川, 陈强, 林超文, 等. 不同植物篱对石灰性紫色土坡耕地土壤微生物学特性影响研究[J]. 土壤, 2012, 44(1): 73-77 DOI:10.3969/j.issn.0253-9829.2012.01.012 (  0) 0) |
| [12] |
傅敏, 郝敏敏, 胡恒宇, 等. 土壤有机碳和微生物群落结构对多年不同耕作方式与秸秆还田的响应[J]. 应用生态学报, 2019, 30(9): 3183-3194 (  0) 0) |
| [13] |
刘芳, 张长生, 陈爱武, 等. 秸秆还田技术研究及应用进展[J]. 作物杂志, 2012(2): 18-23 DOI:10.3969/j.issn.1001-7283.2012.02.005 (  0) 0) |
| [14] |
马晓英, 马琨, 周艳, 等. 土壤细菌群落组成对有机与无机培肥措施的响应[J]. 西北农业学报, 2019, 28(10): 1698-1707 (  0) 0) |
| [15] |
成艳红, 黄欠如, 武琳, 等. 稻草覆盖和香根草篱对红壤坡耕地土壤酶活性和微生物群落结构的影响[J]. 中国农业科学, 2017, 50(23): 4602-4612 DOI:10.3864/j.issn.0578-1752.2017.23.013 (  0) 0) |
| [16] |
徐永刚, 宇万太, 马强, 等. 长期不同施肥制度对潮棕壤微生物生物量碳、氮及细菌群落结构的影响[J]. 应用生态学报, 2010, 21(8): 2078-2085 (  0) 0) |
| [17] |
武琳, 黄欠如, 叶川, 等. 香根草篱对红壤坡耕地坡面土壤酶活性的影响[J]. 土壤, 2013, 45(4): 673-677 (  0) 0) |
| [18] |
钟义军, 叶川, 黄欠如, 等. 红壤区坡耕地香根草篱对花生生长的空间影响[J]. 草业科学, 2013, 30(2): 231-237 (  0) 0) |
| [19] |
鲍士旦. 土壤农化分析(3版)[M].
中国农业出版社, 北京, 2000
(  0) 0) |
| [20] |
Bell C W, Fricks B E, Rocca J D, et al. High-throughput fluorometric measurement of potential soil extracellular enzyme activities[J]. Journal of Visualized Experiments, 2013(81): e50961 (  0) 0) |
| [21] |
Mohd Yusoff M Z, Hu A Y, Feng C J, et al. Influence of pretreated activated sludge for electricity generation in microbial fuel cell application[J]. Bioresource Technology, 2013, 145: 90-96 DOI:10.1016/j.biortech.2013.03.003 (  0) 0) |
| [22] |
侯建伟, 邢存芳, 卢志宏, 等. 不同秸秆生物炭对贵州黄壤细菌群落的影响[J]. 中国农业科学, 2018, 51(23): 4485-4495 DOI:10.3864/j.issn.0578-1752.2018.23.008 (  0) 0) |
| [23] |
王伏伟, 王晓波, 李金才, 等. 施肥及秸秆还田对砂姜黑土细菌群落的影响[J]. 中国生态农业学报, 2015, 23(10): 1302-1311 (  0) 0) |
| [24] |
宋蒙亚, 李忠佩, 吴萌, 等. 不同种植年限设施菜地土壤微生物量和群落结构的差异[J]. 中国农业科学, 2015, 48(18): 3635-3644 DOI:10.3864/j.issn.0578-1752.2015.18.007 (  0) 0) |
| [25] |
Wardle D A. A comparative assessment of factors which influence microbial biomass carbon and nitrogen levels in soil[J]. Biological Reviews, 1992, 67(3): 321-358 DOI:10.1111/j.1469-185X.1992.tb00728.x (  0) 0) |
| [26] |
Wang J C, Song Y, Ma T F, et al. Impacts of inorganic and organic fertilization treatments on bacterial and fungal communities in a paddy soil[J]. Applied Soil Ecology, 2017, 112: 42-50 DOI:10.1016/j.apsoil.2017.01.005 (  0) 0) |
| [27] |
Ren B H, Hu Y M, Chen B D, et al. Soil pH and plant diversity shape soil bacterial community structure in the active layer across the latitudinal gradients in continuous permafrost region of Northeastern China[J]. Scientific Reports, 2018, 8: 5619 DOI:10.1038/s41598-018-24040-8 (  0) 0) |
| [28] |
Ventura M, Canchaya C, Tauch A, et al. Genomics of actinobacteria: Tracing the evolutionary history of an ancient Phylum[J]. Microbiology and Molecular Biology Reviews, 2007, 71(3): 495-548 DOI:10.1128/MMBR.00005-07 (  0) 0) |
| [29] |
Liu J J, Sui Y Y, Yu Z H, et al. High throughput sequencing analysis of biogeographical distribution of bacterial communities in the black soils of northeast China[J]. Soil Biology and Biochemistry, 2014, 70: 113-122 DOI:10.1016/j.soilbio.2013.12.014 (  0) 0) |
| [30] |
田善义, 王明伟, 成艳红, 等. 化肥和有机肥长期施用对红壤酶活性的影响[J]. 生态学报, 2017, 37(15): 4963-4972 (  0) 0) |
| [31] |
Bell C W, Asao S, Calderon F, et al. Plant nitrogen uptake drives rhizosphere bacterial community assembly during plant growth[J]. Soil Biology and Biochemistry, 2015, 85: 170-182 DOI:10.1016/j.soilbio.2015.03.006 (  0) 0) |
| [32] |
黄尚书, 成艳红, 钟义军, 等. 水土保持措施对红壤缓坡地土壤活性有机碳及酶活性的影响[J]. 土壤学报, 2016, 53(2): 468-476 (  0) 0) |
| [33] |
罗俊, 林兆里, 李诗燕, 等. 不同土壤改良措施对机械压实酸化蔗地土壤理化性质及微生物群落结构的影响[J]. 作物学报, 2020, 46(4): 596-613 (  0) 0) |
 2021, Vol. 53
2021, Vol. 53


