2. 遵义师范学院资源与环境学院, 贵州遵义 563006
汞(Hg)是一种持久性、可积累、易挥发的高生物毒性污染物,也是全球目前高度关注、被世界卫生组织等多机构列为优先控制的污染物[1]。贵州作为我国汞矿的重要产地,其储量和产量均位于全国前列,导致该区域环境受汞污染比较广泛[2]。务川汞矿作为贵州大型汞矿之一,有400余年的开采历史,长期的汞矿开采和冶炼加工等过程,加上开采过后的处理方式不当,导致该地区土壤中汞含量上升,对当地土壤生态环境和居民健康等存在潜在威胁[3],土壤汞污染的修复迫在眉睫。目前,国内外还未形成针对汞污染的标准修复技术,应用比较广泛的有物理修复法如客土法与换土法、热脱附修复、电修复等,化学修复法如化学固定法、化学还原法、土壤淋洗法等,以及生物修复法如植物修复、动物修复、微生物修复、联合修复等[4]。其中生物修复技术以其低成本、高效率和生态友好性而成为土壤重金属污染治理的热点之一[5]。土壤微生物修复是生物修复技术中重要的一种,微生物自身生长代谢对土壤中重金属进行氧化还原或吸收沉淀,从而降低重金属的含量及毒性以达到修复的目的[6]。然而相较于单一的微生物修复,植物–微生物联合修复对土壤重金属的富集和固定效率更高,修复效果也更加明显[5]。
丛枝菌根(Arbuscular Mycorrhizal,AM)真菌是土壤生态系统中广泛分布的有益微生物,能与陆地生态系统中90%以上的高等植物根系互惠共生形成菌根[7]。AM共生体在土壤重金属污染修复中能发挥极大的作用,越来越受到研究者的重视[5]。多项研究表明,在重金属污染土壤中,接种外源AM真菌能够极大地提高植物存活率,促进植物个体生长、营养吸收及根系发育等[8-11],说明AM真菌能够很大程度上提高植物对重金属的耐受性。AM真菌的接种还能改变土壤及植物体内重金属的分布,且这一影响因植物和AM真菌种类的改变而改变[12-14]。研究还发现,AM真菌菌丝体对重金属有一定的吸附能力,还可以通过离子交换影响土壤及植物中的重金属含量[15-17]。而在多种重金属污染的土壤中有广泛的AM真菌分布,且重金属污染对土壤AM真菌群落组成及多样性有显著影响[18-19]。
因此,本研究拟探究务川汞矿区土壤优势植物根际AM真菌群落组成及多样性,筛选优势AM真菌,以为植物–AM真菌联合修复土壤汞污染提供理论依据。
1 材料与方法 1.1 样地概况采样地位于贵州省东北部的务川汞矿区,样区多为喀斯特地貌,海拔为700 ~ 1 300 m,属于亚热带高原湿润季风气候,年平均气温15.5 ℃,年均日照时数为1 172.3h,雨量充沛,年均降雨量1 271.7 mm[20]。
在务川汞矿区选择3个不同污染程度的典型样地,分别编号为样地A、B、C。样地A(107°58′45″E,28°33″13′N)位于三家田矿堆附近,该地崎岖不平,其周围的植株较少,植株矮;样地B(107°58′31″E,28°32′59″N)位于银钱沟矿区附近的草地,草本和灌木较多,植株较矮;样地C(108°0′32″E,28°34′36″N)位于老虎沟远离采矿区的农田。3个样地的汞含量分别为A: 268.0 mg/kg;B: 136.0 mg/kg;C: 94.1 mg/kg。
1.2 样品采集与处理本研究于2021年5月在经过初步调查后,在贵州务川汞矿区样地A选取物种丰度较高的火棘和马桑,在样地B选取物种丰度较高的火棘和黄荆,在样地C选取物种丰度较高的火棘,根据五点取样法,每种植物选取3株长势良好且大小相似的植株,采集其根系及根际土。取样时,除去植物根部0~5 cm的表层土,取5 ~ 20 cm深度的土壤剖面,用75%(V/V)乙醇擦拭枝剪,剪取带有细根的根系,轻轻抖落附着在根系上的土壤,将剩下的土壤用小刷子刷至无菌自封袋中,同时将根系也装入自封袋中,贴好标签,置于冰盒中带回实验室。采集到的根系保存于FAA固定液(福尔马林5 mL、70%(V/V)乙醇90 mL、冰醋酸5 mL)中,土样一部分自然风干用于孢子密度的测定,一部分保存在–80℃超低温冰箱中用于分子生物学试验。
1.3 AM真菌侵染率的测定AM真菌侵染率的测定采用Koske和Gemma[21]的方法并稍加修改。首先,将根系样品清洗干净,置于FAA固定液中;接着将FAA固定的根系剪成1.0 cm左右的小段放入玻璃试管中,加入0.45mol/L的KOH溶液,置于90 ℃水浴锅内煮沸1 h,可重复更换碱液,直到碱液颜色清澈透明,倒掉碱液;然后用H2O2漂白,室温下保持30 min,再用自来水冲洗3次以上,加入1%(V/V)的HCl,酸化1 h;随后倒掉酸液后,加入0.5 g/L的曲利苯蓝,放入90℃水浴锅中煮沸20 min染色;最后用乳酸甘油浸泡过夜脱色,随机选取长度为1 cm的根段制作成装片,每个样品数量为100条,在光学显微镜下观察菌根侵染情况。根据以下公式计算每个样品的菌根侵染率[22]:侵染率(%)= (AM真菌侵染根段数/检查总根段数)×100%。
1.4 AM真菌孢子密度的测定土样自然风干后用Geremann和Nicolson[23]的湿筛倾析法加以修改测定AM真菌孢子密度。具体为:称取100 g土壤样品,置于烧杯中,用少量水浸泡20 ~ 30 min使土壤样品湿润并疏松;向烧杯中加入1 L自来水,用玻璃棒迅速搅动土壤溶液,静置15 s;待较大的砾石和颗粒沉淀后,使土壤悬浮液缓慢通过一系列土壤筛(710、250、45 μm),土壤悬浮液尽量保持倒在土壤筛的同一个位置;用清水冲洗网筛,液体通过布式漏斗抽滤至滤纸上,然后将湿润的滤纸转移至培养皿中;最后在双目解剖镜下分别计数各筛面的孢子数目。统计每100 g土样中含有的AM真菌孢子的数量计为AM真菌孢子密度。
1.5 AM真菌的高通量测序采用E.Z.N.A.Soil DNA Kit (D5625-01)提取土壤总DNA,进行巢式PCR扩增。扩增方法如下:第一次PCR扩增引物是AML1F(5'-ATCAACTTTCGATG GTAGGATAGA-3′)和AML2R(5'-GAACCCAAACAC TTTGGTTTCC-3′),产物约800bp。扩增程序为:94℃预变性3 min;94 ℃变性1 min,50 ℃退火1 s,72 ℃延伸1 s,共循环30次;最后72 ℃延伸5 min。第一次PCR扩增产物作为第二次PCR扩增的模板,第二次PCR扩增引物是AMV4.5NF(5'-AAGCTCGTAG TTGAATTTCG-3')和AMDGR(5'-CCCAACTATCCCT ATTAATCAT-3'),产物约300bp。扩增程序为:94 ℃预变性3 min;94 ℃变性1 min,50 ℃退火1 s,72 ℃延伸1 s,共循环30次;最后72 ℃延伸5 min。PCR扩增产物经检测后,委托上海生工生物工程股份有限公司进行高通量测序。
1.6 数据分析将二代测序得到的PE reads,根据overlap关系进行拼接,区分样本后对序列质量进行质控和过滤,然后按照97%相似性对非重复序列(不含单序列) 进行OTU(Operational Taxonomic Unit)聚类。采用RDP classifier,基于NCBI GenBank库对代表序列进行分类学注释,并进行Alpha多样性分析,及计算AM真菌群落多样性指数。采用SPSS 19.0软件对汞含量与AM真菌侵染率、孢子密度及Alpha多样性指数进行相关性分析。
2 结果与分析 2.1 汞污染样地AM真菌侵染率和孢子密度如表 1所示,不同水平汞污染地优势植物根系均存在AM真菌侵染,AM真菌侵染率和孢子密度表现为C样地 > B样地 > A样地,且差异显著(P < 0.05)。根据各样地汞含量数据可以看出,AM真菌侵染率和孢子密度随着汞含量的升高而降低,而同一样地不同植物之间AM真菌侵染率和孢子密度差异不显著。
|
|
表 1 不同含量汞污染对土壤AM真菌侵染率和孢子密度的影响 |
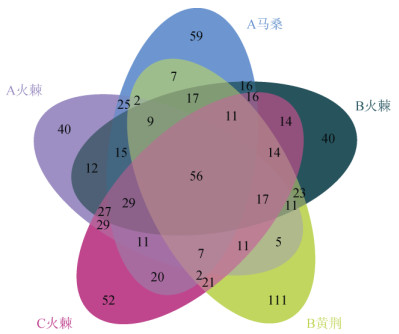
测序结果显示,所有样本中共检测到1 596个AM真菌OTU,其中5个样本中共有OTU数为56个,B样地黄荆特有OTU数最多为111个,随着汞含量降低,植物根际AM真菌群落OTU数显著提高(P < 0.05),同一样地不同植物根际AM真菌群落OTU数并无显著差异(图 1)。
|
图 1 不同含量汞污染样地植物根际土壤AM真菌群落OTU韦恩图 |
对聚类后的OTU进行物种注释发现,所有AM真菌隶属于1门1纲2目2科3属,1门是球囊菌门(Glomeromycota),1纲是球囊菌纲(Glomeromycetes),2目分别是球囊霉目(Glomerales)、巨孢囊霉目(Gigasporales),2科分别是球囊霉科(Glomeraceae)、巨孢囊霉科(Gigasporaceae),3属分别是球囊霉属(Glomus)、管柄囊霉属(Funneliformis)、盾巨孢囊霉属(Scutellospora)。其中,管柄囊霉属在5个样本中均有较高的分布,在不同含量汞污染条件下火棘根际及B样地黄荆根际均为第一优势属,且其丰度在不同宿主之间的差异较大;盾巨孢囊霉属在A、C样地均有较高分布,是A样地马桑根际第一优势属;球囊霉属在3个样地火棘根际均有一定的分布,且随着汞含量降低,其相对丰度也随之降低,但在汞含量最高的A样地马桑根际也有较高的丰度。
2.4 汞污染样地植物根际土壤AM真菌多样性从表 2可以看出,汞含量最低的C样地火棘根际土壤AM真菌Chao指数显著高于A样地马桑根际土壤及B样地黄荆根际土壤(P < 0.05),高于A、B样地火棘根际土壤(P > 0.05);C样地火棘根际土壤AM真菌Ace指数显著高于B样地黄荆根际土壤(P < 0.05),高于A样地火棘、马桑根际土壤及B样地火棘根际土壤(P > 0.05);A、B样地火棘根际土壤AM真菌丰富度指数(Chao指数、Ace指数)无显著差异(P > 0.05)。土壤AM真菌群落Simpson多样性指数表现为C样地火棘根际土壤显著低于A样地马桑根际土壤和B样地火棘、黄荆根际土壤(P < 0.05),低于A样地火棘(P > 0.05);Shannon多样性指数表现为C样地火棘根际土壤显著高于A样地马桑根际土壤和B样地黄荆根际土壤(P < 0.05),高于A、B样地火棘根际土壤(P > 0.05),均匀度指数(Shannoneven指数)表现为C样地火棘根际土壤显著高于A样地马桑根际土壤和B样地黄荆根际土壤(P < 0.05),高于A、B样地火棘根际土壤(P > 0.05)。
|
|
表 2 不同含量汞污染样地植物根际土壤AM真菌多样性指数 |

|
(本文将在数据库中没有找到该序列分类信息、无法进行分类的归为unclassified,将在所有样本中丰度占比均小于1% 的物种归为others) 图 2 不同含量汞污染样地植物根际土壤AM真菌在属水平的相对丰度 |
AM真菌资源分布受到土壤汞含量的影响,土壤汞含量对AM真菌群落多样性、丰富度和均匀度均有影响,其中对AM真菌侵染率和孢子密度的影响较大。相关性分析结果表明,根际土壤AM真菌多样性与土壤汞含量存在一定的相关性(表 3),其中Chao指数、Ace指数、Shannon指数、Shannoneven指数与汞含量呈负相关,Simpson指数与汞含量呈正相关,侵染率和孢子密度与汞含量呈极显著负相关(P < 0.01)。
|
|
表 3 汞含量与AM真菌多样性的相关性 |
根际微生物的多样性及活性受土壤营养、水分、污染因素等的影响[24] ,不同程度土壤污染及植物种类会影响根际微生物群落分布及其在根际的定殖等[25]。徐舟影[19]研究表明,铅锌矿区土壤铅污染越严重,根际土壤AM真菌多样性越低。Weissenhorn等[26]研究指出,高含量重金属污染会降低AM真菌孢子密度和物种丰度。Schneider等[27]研究发现,随着土壤重金属含量增加,AM真菌孢子丰富度、种类及多样性会随之下降。本研究结果与以上研究结果一致。本研究发现,随着汞含量增加,AM真菌侵染率、孢子密度均随之降低,这可能是因为髙含量重金属会抑制AM真菌孢子萌发和菌丝生长,对多数AM真菌产生毒害。
滕应等[28]研究表明,尾矿区土壤微生物群落丰富度、多样性指数均显著低于非矿区土壤,尾矿区重金属污染导致土壤微生物群落功能多样性下降。覃佳名等[6]指出,重金属对微生物具有一定的毒害作用,会影响微生物对土壤的修复功能。本研究发现,随着汞含量的增加,AM真菌群落丰度、多样性及均匀度均有所下降,说明汞污染对AM真菌群落组成和分布等均有一定负面影响,但仍有部分对汞污染耐受性较强的AM真菌有较高的分布。本研究中,管柄囊霉属AM真菌在5个样品中均有较高丰度,且其丰度在不同宿主之间的差异较大,说明管柄囊霉属AM真菌对汞污染并不敏感,对汞的耐受性强,但其对宿主的选择性比较大。因此,可以进一步探究通过管柄囊霉属真菌联合其最适宿主对土壤汞污染进行修复。大量研究发现,球囊霉属AM真菌生态适应性强,在很多生态系统中都属于优势属[29-30]。本研究中,球囊霉属AM真菌在3个样地火棘根际均有一定的分布,且随着汞含量升高,其相对丰度也随之升高,说明球囊霉属AM真菌可能在抵御重金属方面有一定的作用,因此,可进一步探索球囊霉属真菌在汞污染修复中的作用。
4 结论1) 务川汞矿区3个样地土壤汞含量在94.1~ 268.0 mg/kg,其中老虎沟样地位于农田附近,汞污染已达94.1mg/kg,远高于国家规定的土壤汞含量,汞污染极其严重,汞污染修复迫在眉睫。
2) 在高含量汞污染地区,仍然有大量的耐汞植物和AM真菌分布,可考虑植物–AM真菌共生体联合修复土壤汞污染。研究区火棘–管柄囊霉属AM真菌或火棘–球囊霉属AM真菌共生体对汞具有较高的耐受性,可用于土壤汞污染的修复。
| [1] |
王璐, 陈功锡, 杨胜香, 等. 汞污染土壤植物修复研究现状与展望[J]. 地球与环境, 2022, 50(5): 754-766 (  0) 0) |
| [2] |
李强, 郭飞, 莫测辉, 等. 贵州省环境中汞污染现状与分布特征[J]. 生态科学, 2013, 32(2): 235-240 (  0) 0) |
| [3] |
李平, 冯新斌, 仇广乐, 等. 贵州省务川汞矿区土法炼汞过程中汞释放量的估算[J]. 环境科学, 2006, 27(5): 837-840 (  0) 0) |
| [4] |
胡焱鑫. 铜仁汞矿区稻田土壤汞污染修复及机理研究[D]. 贵阳: 贵州大学, 2021: 2–4.
(  0) 0) |
| [5] |
李信茹, 米屹东, 魏源, 等. 丛枝菌根真菌-植物共生体系在重金属污染土壤修复上的研究进展[J]. 现代化工, 2020, 40(5): 14-18 (  0) 0) |
| [6] |
覃佳名, 姜必广, 南小龙, 等. 重金属污染土壤微生物修复研究进展[J]. 环境科学与技术, 2021, 44(S2): 132-143 (  0) 0) |
| [7] |
金樑, 孙莉, 王强, 等. AM真菌在草原生态系统中的功能[J]. 生态学报, 2016, 36(3): 873-882 (  0) 0) |
| [8] |
李少朋, 毕银丽, 孔维平, 等. 丛枝菌根真菌在矿区生态环境修复中应用及其作用效果[J]. 环境科学, 2013, 34(11): 4455-4459 (  0) 0) |
| [9] |
杨玉荣. 丛枝菌根真菌(AMF)提高植物修复土壤重金属Pb污染的作用机制[D]. 杨凌: 西北农林科技大学, 2015.
(  0) 0) |
| [10] |
Mathur S, Sharma M P, Jajoo A. Improved photosynthetic efficacy of maize (Zea mays) plants with arbuscular mycorrhizal fungi (AMF) under high temperature stress[J]. Journal of Photochemistry and Photobiology B: Biology, 2018, 180: 149-154 DOI:10.1016/j.jphotobiol.2018.02.002 (  0) 0) |
| [11] |
Zhang Y, Hu J L, Bai J F, et al. Intercropping with sunflower and inoculation with arbuscular mycorrhizal fungi promotes growth of garlic chive in metal-contaminated soil at a WEEE-recycling site[J]. Ecotoxicology and Environmental Safety, 2019, 167: 376-384 (  0) 0) |
| [12] |
郑文君, 王明元. 接种丛枝菌根真菌对蜈蚣草吸收铀的影响[J]. 环境科学, 2015, 36(8): 3004-3010 (  0) 0) |
| [13] |
Chen B D, Jakobsen I, Roos P, et al. Effects of the mycorrhizal fungus Glomus intraradices on uranium uptake and accumulation by Medicago truncatula L. from uranium-contaminated soil[J]. Plant and Soil, 2005, 275(1): 349-359 (  0) 0) |
| [14] |
Zhan F D, Li B, Jiang M, et al. Effects of arbuscular mycorrhizal fungi on the growth and heavy metal accumulation of bermudagrass[Cynodondactylon (L.) Pers.]grown in a lead-zinc mine wasteland[J]. International Journal of Phytoremediation, 2019, 21(9): 849-856 (  0) 0) |
| [15] |
Zhang X F, Hu Z H, Yan T X, et al. Arbuscular mycorrhizal fungi alleviate Cd phytotoxicity by altering Cd subcellular distribution and chemical forms in Zea mays[J]. Ecotoxicology and Environmental Safety, 2019, 171: 352-360 (  0) 0) |
| [16] |
陈保冬, 李晓林, 朱永官. 丛枝菌根真菌菌丝体吸附重金属的潜力及特征[J]. 菌物学报, 2005, 24(2): 283-291 (  0) 0) |
| [17] |
徐丽娇, 郝志鹏, 谢伟, 等. 丛枝菌根真菌根外菌丝跨膜H+和Ca2+流对干旱胁迫的响应[J]. 植物生态学报, 2018, 42(7): 764-773 (  0) 0) |
| [18] |
肖艳萍, 李涛, 费洪运, 等. 云南金顶铅锌矿区丛枝菌根真菌多样性的研究[J]. 菌物学报, 2008, 27(5): 652-662 (  0) 0) |
| [19] |
徐舟影. 丛枝菌根真菌提高狼牙刺耐Pb机制的研究[D]. 杨凌: 西北农林科技大学, 2013.
(  0) 0) |
| [20] |
贵州省地方志编纂委员会. 贵州省志-有色金属工业志[M].
贵州人民出版社, 贵阳, 2002: 148-149
(  0) 0) |
| [21] |
Koske R E, Gemma J N. A modified procedure for staining roots to detect VA mycorrhizas[J]. Mycological Research, 1989, 92(4): 486-488 (  0) 0) |
| [22] |
仲崇禄, 弓明钦, 康丽华. 土壤元素与木麻黄生长和VA菌根菌侵染率的关系[J]. 林业科学研究, 1998, 11(2): 135-141 (  0) 0) |
| [23] |
Gerdemann J W, Nicolson T H. Spores of mycorrhizal Endogone species extracted from soil by wet sieving and decanting[J]. Transactions of the British Mycological Society, 1963, 46(2): 235-244 (  0) 0) |
| [24] |
Margesin R, Płaza G A, Kasenbacher S. Characterization of bacterial communities at heavy-metal-contaminated sites[J]. Chemosphere, 2011, 82(11): 1583-1588 (  0) 0) |
| [25] |
Vik U, Logares R, Blaalid R, et al. Different bacterial communities in ectomycorrhizae and surrounding soil[J]. Scientific Reports, 2013, 3: 3471 (  0) 0) |
| [26] |
Weissenhorn I, Leyval C, Berthelin J. Cd-tolerant arbuscular mycorrhizal (AM) fungi from heavy-metal polluted soils[J]. Plant and Soil, 1993, 157(2): 247-256 (  0) 0) |
| [27] |
Schneider J, Stürmer S L, Guilherme L R G, et al. Arbuscular mycorrhizal fungi in arsenic-contaminated areas in Brazil[J]. Journal of Hazardous Materials, 2013, 262: 1105-1115 (  0) 0) |
| [28] |
滕应, 黄昌勇, 骆永明, 等. 铅锌银尾矿区土壤微生物活性及其群落功能多样性研究[J]. 土壤学报, 2004, 41(1): 113-119 (  0) 0) |
| [29] |
米屹东, 李信茹, 刘秀明, 等. 喀斯特地区丛枝菌根真菌多样性研究进展[J]. 地球与环境, 2020, 48(5): 631-641 (  0) 0) |
| [30] |
姚莉梅, 尚昆, 朱青青, 等. 合江方竹根际土壤丛枝菌根真菌多样性[J]. 东北林业大学学报, 2020, 48(3): 110-115 (  0) 0) |
2. College of Resources and Environment, Zunyi Normal University, ZunYi, Guizhou 563006, China
 2023, Vol. 55
2023, Vol. 55

