2. 中国科学院大学, 北京 100049
我国酸性土壤(pH≤5.5)面积达218万km2,主要分布在水热资源丰富、农林生产潜力巨大的南方红壤区[1]。酸性红壤特点在于养分贫瘠和胁迫因子众多,其中低的磷素有效性是红壤生产潜力难以有效发挥的一个重要因素[2]。丛枝菌根真菌(Arbuscular Mycorrhizal Fungi,AMF)是一类能与80% 以上陆生植物共生的真菌群落,可扩大植物根系吸收磷的空间范围,提高植物对土壤磷素的利用,与作物的生长和健康密切相关[3]。因此,发挥与植物共生的AMF群落功能对提高酸性红壤磷素利用具有重要意义。
土壤AMF分布广泛,种类繁多,其生理生态功能与群落多样性和组成结构密切相关,不同的AMF群落组成通常具有不同的功能[4]。在人类干扰活动中,施肥措施是影响AMF群落的重要因素,其中磷肥尤为重要,因为磷素与AMF的定殖和生长发育最为密切[5]。尽管已经明确磷肥可改变AMF–植物共生体系利益分配关系,但是AMF群落对磷肥的响应并不一致。例如,青藏高原高寒草甸根系AMF群落受磷肥的影响不明显[6];在草地生态系统中,磷肥增强AMF与狗牙根的共生,加快了狗牙根再生速度[7];而在农田生态系统中,磷肥却降低了土壤AMF群落功能和生物多样性[8-9]。AMF群落对磷肥的响应差异可能归因于不同的生态系统、土壤类型、土壤肥力水平以及磷肥施用量等因素[3, 10]。一般情况下,在肥力较低的土壤上施磷肥时,AMF能够扩大植物根系吸收养分的面积,表现出较强的活性[11]。而当土壤有效磷含量较高时,磷肥反而抑制AMF生长、定殖及功能,降低AMF群落多样性和丰富度[12]。目前,磷肥对酸性红壤AMF群落的影响还鲜有报道,进而限制AMF在酸性红壤上的应用。
AMF定殖在植物根部,参与植物的生理代谢过程,与植物特性密不可分[13]。受植物根系分泌物中有机物和信号分子等物质的“招募”和促生作用,AMF侵染宿主根系,并在根际区域富集,形成了定殖的独特生态位[14]。然而,不同AMF物种对根系分泌物的“招募”作用响应不同,导致AMF群落在植物根系、根际和非根际区域往往表现出不同的分布特征[15]。此外,磷肥水平可能通过影响植物生长、根系分泌物量及组成进而决定AMF群落在根中的定殖和根际的促生强度[16]。因此,在施磷措施下,AMF群落受到磷肥和植物双重影响,但这两个因素的相对作用强度并不清楚。因此,本研究通过设置不同磷肥水平,分析酸性红壤上玉米不同部位AMF群落多样性和组成结构,试图明确玉米不同部位AMF群落的分布特征及对磷肥的响应差别,为提高酸性红壤磷素利用提供理论支撑。
1 材料与方法 1.1 盆栽试验供试土壤取自中国科学院鹰潭国家农业生态系统观测研究站(28°15′ N,116°55′ E) 的松树林。该地区主要气候为亚热带季风性湿润气候,年降水量为1 881.8 mm,土壤为酸性红黏土,由第四纪红黏土发育而成。供试玉米品种选用先玉335。
于2020年4月在中国科学院南京土壤研究所温室中进行盆栽试验,培养条件为自然光照,平均气温为25℃。每盆装2.0 kg土壤,氮肥以硫酸铵形式施用(N 88.9 g/kg),磷肥以磷酸二氢钾形式添加,并补充硫酸钾,保证每盆钾添加量相同(K 62.9 mg/kg)。试验共设置3个磷肥水平:不施磷(P0,P 0 mg /kg)、低磷(LP,P 25 mg/kg)和高磷(HP,P 100 mg /kg),每个磷肥水平6盆。在玉米播种前,先将基肥和土壤充分混匀,浇灭菌的纯净水,平衡一周。每个磷肥水平分别种植3盆,每盆播种5粒玉米种子,在地上部长到1 cm时间苗,每盆留3棵幼苗。自间苗之日起,进行为期4周的培养,其间土壤含水量保持在20% (m/m)。同时设置不种玉米的处理用于收集非根际土。
培养结束后,分别收集玉米根系和地上部,采用抖根法收集根际土壤。收集每盆玉米所有根际土并混匀,相应的根系和地上部也分别混合为1个样品。取一部分根部样品保存于–80℃冰箱,用于根部DNA的提取。土壤样品过2 mm筛后分为3份,一份新鲜土样储存在4℃冰箱中,用于测定铵态氮和硝态氮含量;一份风干后测定其他土壤理化性质;其他部分存放在–80℃冰箱以提取土壤DNA。
1.2 玉米植株磷含量和土壤理化性质测定用蒸馏水冲洗根系和地上部样品,并于105℃杀青,随后70℃烘干至恒重,称重。样品粉碎,经HNO3消煮后,采用钼锑抗比色法测定磷含量。
土壤理化性质测定参照《土壤农业化学分析方法》[17]。土壤pH采用pH计测定;有机质和全氮含量分别采用硫酸–重铬酸钾氧化法和凯氏定氮法测定。铵态氮和硝态氮含量采用氯化钾浸提新鲜土壤,用连续流动分析仪测定;有效磷含量使用盐酸–氟化铵溶液浸提土壤,用钼蓝比色法测定;速效钾含量采用醋酸铵溶液浸提土壤,使用火焰光度法测定。
1.3 根部和土壤DNA提取和高通量测序使用DNA试剂盒(FastDNA SPIN Kit for soil)提取根部和土壤样品DNA。将新鲜玉米根部样品用无菌剪刀剪成2 cm的小段,70% 酒精浸泡30 ~ 60 s,10% NaCl处理10 min进行表面灭菌,然后无菌水冲洗4次,每次10 min,最后一次洗涤的无菌水涂布在LB平板上作为对照,确定是否消毒彻底。将消毒的根部样品采用DNA试剂盒提取植株DNA。以提取的DNA为模板,进行PCR扩增。AMF的特异性引物为AMV4.5NF(5′-AAGCTCGTAGTTGAATTTCG-3′)和AMDGR(5′-CCCAACTATCCCTATTAATCAT-3′)[18]。在每个样品的上游引物5'端添加一段长度为7 bp的特异性多肽以区分样品。参照Lee等[19]的方法进行PCR反应。利用Illumina MiSeq250测序平台进行高通量测序(上海派森诺生物技术有限公司)。
使用QIIME v1.9.1软件处理测序数据。序列经过质量过滤,去除嵌合序列得到高质量的Tags序列。在相似性97% 的水平上对序列进行聚类,并选取每个操作分类单元(operational taxonomic unit,OTU)中丰度最高的序列作为代表序列,基于NCBI GenBank库对代表序列进行分类学注释。将每个样品的OTU序列稀释到相同水平(16 199个有效序列),用于α和β多样性分析。
1.4 数据分析采用SPSS 22.0软件的单因素方差分析(One-way ANOVA)检验磷肥处理间玉米干重、地上部磷含量、根际和非根际土壤理化性质的差异显著性,采用双因素方差分析(ANOVA)检验磷肥水平和取样位点(根部、根际和非根际土壤)对AMF群落优势属相对丰度和α多样性的影响(R语言“vegan”包)。
基于Bray-Curtis距离,采用非度量多维标度(NMDS)展示AMF群落的组成结构。置换多元方差分析(PERMANOVA)用于检验磷肥水平和取样位点对AMF群落结构影响差异的显著性。以上分析均使用R软件“vegan”包完成。
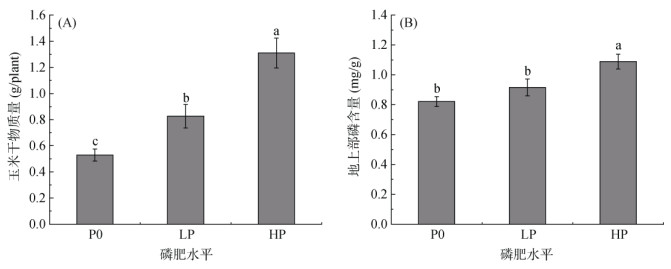
2 结果与分析 2.1 玉米生物量、地上部磷含量及土壤理化性质随着磷肥水平的增加,玉米生物量显著提高(P < 0.05, 图 1A),而且高磷处理玉米地上部磷含量显著高于不施磷和低磷处理(P < 0.05,图 1B)。
|
柱图上方不同小写字母表示在不同磷肥水平间差异显著(P < 0.05) 图 1 不同磷肥水平下玉米生物量(A)和地上部磷含量(B) Fig. 1 Biomass and aboveground phosphorus contents of maize under different P fertilizer levels |
双因素方差分析表明,施磷显著提高了土壤有效磷含量(P < 0.05),取样位点(根际和非根际)显著影响了土壤pH、铵态氮、硝态氮、速效钾、有机质和全氮含量(P < 0.05,表 1)。根际土壤pH、铵态氮、硝态氮和速效钾含量显著低于非根际土壤(P < 0.05),根际土壤碳氮比(C/N)只在高磷条件下显著高于非根际土壤(P < 0.05)。
|
|
表 1 不同磷肥水平下玉米根际和非根际土壤理化性质 Table 1 Soil physiochemical properties of maize rhizosphere and non-rhizosphere soils under different P fertilizer levels |
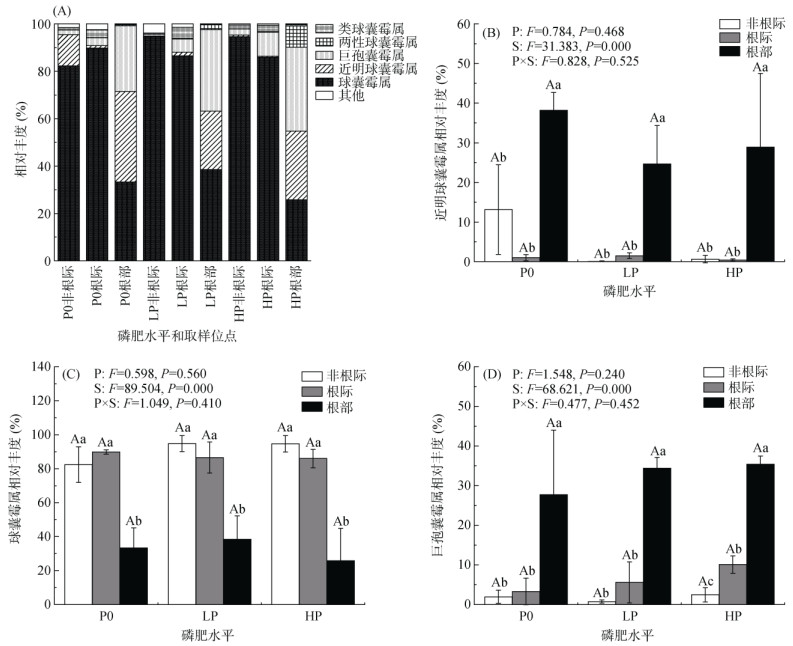
图 2A所示,玉米根部、根际和非根际土壤中AMF群落优势属(相对丰度 > 1%)包括球囊霉属(Glomus,25.8% ~ 94.8%)、巨孢囊霉属(Paraglomus,0.7% ~ 35.4%)、两性球囊霉属(Archaeospora,0.0% ~ 9.1%)、近明球囊霉属(Claroideoglomus,0.1% ~ 38.2%)和类球囊霉属(Gigaspora,0.1% ~ 4.7%)。在非根际和根际土壤中,球囊霉属为相对丰度最高的属,在低磷非根际土壤中占比高达94.8%。双因素方差分析显示,取样位点(根部、根际和非根际土壤)而非磷肥水平显著影响了近明球囊霉属、巨孢囊霉属和球囊霉属的相对丰度(P < 0.05,图 2B ~ 2D),玉米根部近明球囊霉属和巨孢囊霉属相对丰度显著高于根际和非根际土壤(P < 0.05,图 2B和2D),然而根际和非根际土壤中球囊霉属相对丰度显著高于根部样品(P < 0.05,图 2C)。
|
柱图上方不同小写字母表示同一磷肥水平下不同取样位点间差异显著(P < 0.05),不同大写字母表示同一取样位点在不同磷肥水平间差异显著(P < 0.05),图例中S表示取样位点,P表示磷肥水平;下同 图 2 不同磷肥处理下不同取样位点AMF群落优势属(相对丰度 > 1%) Fig. 2 Relative abundances of dominant AMF genus (> 1%) at different sampling sites under different P fertilizer levels |
双因素方差分析表明,取样位点(根部、根际和非根际土壤)显著影响了AMF群落的香农指数和物种丰富度(P < 0.05,图 3),而磷肥水平并未显著影响这些指标(P > 0.05)。在不施磷和低磷水平下,与非根际土壤相比,根际土壤显著提高了AMF群落的香农指数(P < 0.05,图 3A)。在施磷处理下(低磷和高磷),根际土壤AMF物种丰富度显著高于非根际土壤(P < 0.05),高磷处理下根际土壤AMF物种丰富度显著高于根部样品(P < 0.05,图 3B)。

|
图 3 不同磷肥处理下玉米根部、根际和非根际土壤AMF群落多样性指数 Fig. 3 AMF diversity indexes of maize root, rhizosphere and non-rhizosphere soils under different P fertilizer levels |
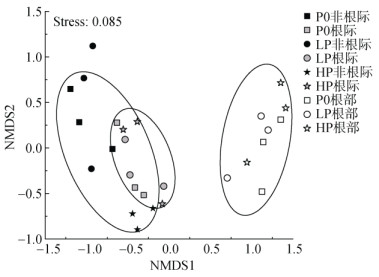
采用NMDS分析了不同磷肥水平下玉米根部、根际和非根际土壤AMF群落组成结构(图 4)。结果显示,根部样品与非根际和根际土壤样品群落距离更远,非根际和根际土壤样品群落距离相对紧凑。相同取样位点中,不同磷肥水平间更为相似。PERMANOVA检验显示,取样位点显著影响了AMF群落组成结构(P < 0.05,表 2),但是磷肥水平并未显著影响(P > 0.05)。AMF群落在非根际和根际样品间未形成显著性差异,根际和根部样品间(F=20.470,P=0.001)以及非根际与根部样品间的差异(F=24.685,P=0.001)达到显著水平。
|
图 4 不同磷肥处理下不同取样位点AMF群落结构的NMDS分析 Fig. 4 NMDS analysis of AMF communities of different sampling sites under different P fertilizer levels |
|
|
表 2 磷肥处理下玉米根部、根际和非根际土壤AMF群落组成的PERMANOVA分析 Table 2 PERMANOVA analysis (global test and pairwise comparison) of AMF community compositions of maize root, rhizosphere and non-rhizosphere soils under different P fertilizer levels |
本研究结果显示,酸性红壤上玉米根部、根际和非根际土壤(取样位点)间AMF群落多样性和组成结构的差异程度高于磷肥水平的影响(图 3和表 2),主要体现在根部AMF群落组成结构明显不同于根际和非根际土壤,根际土壤表现出更高的多样性指数。高的多样性指数说明更多AMF物种在根际土壤中聚集,这可能与丰富且种类多样的根系分泌物在根际区域的存在密切相关[15, 20]。据报道,植物提供的光合产物可直接影响根际土壤AMF的生长和代谢[21]。类似地,施磷肥的东北黑土中小麦根际土壤富集了更多AMF物种[22]。张之为等[23]研究认为,马铃薯根际土壤中营养成分对AMF孢子数量影响较大,提高根际有机质含量会增加土壤AMF多样性。相比于土壤,植物根部具有独特的AMF专性共生生态位,导致土壤与根部AMF群落组成存在较大差异。陈梅梅等[24]也研究发现,尽管磷素水平对三叶草根系AMF的定殖产生了影响,但是其根系还定殖了不受磷素影响的AMF物种。高磷的土壤环境一般会限制宿主根部与AMF的营养交换,抑制AMF的生长、发育和功能。相比之下,植物特性也是影响AMF群落结构的重要因素。本研究结果暗示,酸性红壤上玉米根系对AMF物种的选择和刺激作用表现出比磷肥更为重要的影响。通常认为,根系分泌物是AMF营养物质和“招募信号”的主要来源,土壤环境通过改变根系分泌物的数量和组成,招募AMF种类,并促进或抑制某些AMF物种的生长发育,进而影响植物根系AMF群落结构特征[25]。
本研究中,酸性红壤上玉米不同取样位点AMF群落由不同的优势属组成,是导致群落结构差异的主要原因。球囊霉属(Glomus)是酸性红壤AMF相对丰度最大的属,但是该属相对丰度在玉米根部明显降低,而巨孢囊霉属(Paraglomus)和近明球囊霉属(Claroideoglomus)在根系中的相对丰度明显增加(图 2)。AMF种类在植物根系中的富集与其本身生理生态特征以及被“招募作用”密切相关[26]。根据赵慧敏[27]和薛壮壮等[28]的报道,球囊霉属孢子萌发和丛枝结构形成受环境pH的影响较大。中性至微酸性环境更利于球囊霉属孢子的根系定殖,然而酸性土壤较低的pH可能降低了球囊霉属在玉米根系中的定殖(表 1)。Abbott和Robson[29]研究表明,在低pH土壤中,苜蓿根部球囊霉属菌丝体的伸展受到强烈抑制,相比之下,植物根内较稳定的封闭环境有利于巨孢囊霉属和近明球囊霉属的根系定殖。Gosling等[30]也发现,施肥管理下玉米根系定殖了更多的巨孢囊霉属和近明球囊霉属。本研究中,巨孢囊霉属和近明球囊霉属在玉米根部相对丰度的增加,说明其对酸性土壤环境具有较强的适应能力。因此,酸性红壤上玉米根系可能加大对巨孢囊霉属和近明球囊霉属的能量供应,从而获得更多的磷素。
在酸性红壤上,磷肥对玉米根部、根际和非根际土壤AMF群落多样性和组成结构没有显著影响(图 3和表 2),反映了酸性红壤AMF群落对磷肥不敏感的特性。这不同于以往的大多数研究结果,例如王庆峰等[31]发现施用磷肥改变了黑土中AMF群落组成,降低其多样性;Qin等[32]报道,施用磷肥能够增强根系菌丝共生体活性,提高AMF孢子生物量。这可能是由于微生物群落还受气候条件、土壤类型、土壤肥力等因素的影响[33]。因此,研究施肥对AMF群落的影响时,需同时考虑地理区位和土壤类型等其他因素。本研究结果可能归因于酸性红壤本身特点导致磷素极易被土壤固定,尽管施用磷肥,但是土壤磷素有效性仍然很低(表 1),施用的磷肥可能还不足以达到显著影响AMF群落的水平。此外,不利于AMF群落的酸性土壤条件可能增强了AMF物种对环境的适应性,维持了AMF群落的稳定性,从而降低其对磷肥的敏感性。
4 结论酸性红壤上,玉米不同部位AMF群落的差异程度明显高于磷肥施用。根部AMF群落组成与土壤样品的差异最为明显,主要体现在富集的优势菌属不同,根部富集更多的巨孢囊霉属和近明球囊霉属,而根际区域表现出更高的AMF多样性。酸性红壤特征可能决定了AMF群落对磷肥的不敏感性。
| [1] |
赵其国. 红壤物质循环及其调控[M].
科学出版社, 北京, 2002
(  0) 0) |
| [2] |
陈利军, 蒋瑀霁, 王浩田, 等. 长期施用有机物料对旱地红壤磷组分及磷素有效性的影响[J]. 土壤, 2020, 52(3): 451-457 DOI:10.13758/j.cnki.tr.2020.03.004 (  0) 0) |
| [3] |
黄艳飞, 吴庆丽, 万群, 等. 丛枝菌根真菌的研究进展[J]. 现代农业, 2019(12): 9-12 DOI:10.3969/j.issn.1007-5739.2019.12.007 (  0) 0) |
| [4] |
苗原, 吴会芳, 马承恩, 等. 菌根真菌与吸收根功能性状的关系: 研究进展与评述[J]. 植物生态学报, 2013, 37(11): 1035-1042 (  0) 0) |
| [5] |
Chen Y L, Zhang X, Ye J S, et al. Six-year fertilization modifies the biodiversity of arbuscular mycorrhizal fungi in a temperate steppe in Inner Mongolia[J]. Soil Biology and Biochemistry, 2014, 69: 371-381 DOI:10.1016/j.soilbio.2013.11.020 (  0) 0) |
| [6] |
林昕, 董强, 王平, 等. 氮、磷添加对青藏高原高寒草甸丛枝菌根真菌群落的影响[J]. 华南农业大学学报, 2020, 41(2): 95-103 (  0) 0) |
| [7] |
叶少萍, 曾秀华, 辛国荣, 等. 不同磷水平下丛枝菌根真菌(AMF)对狗牙根生长与再生的影响[J]. 草业学报, 2013, 22(1): 46-52 (  0) 0) |
| [8] |
Lin X G, Feng Y Z, Zhang H Y, et al. Long-term balanced fertilization decreases arbuscular mycorrhizal fungal diversity in an arable soil in North China revealed by 454 pyrosequencing[J]. Environmental Science & Technology, 2012, 46(11): 5764-5771 (  0) 0) |
| [9] |
Beauregard M S, Hamel C, Atul-Nayyar, et al. Long-term phosphorus fertilization impacts soil fungal and bacterial diversity but not AM fungal community in alfalfa[J]. Microbial Ecology, 2010, 59(2): 379-389 DOI:10.1007/s00248-009-9583-z (  0) 0) |
| [10] |
马忠莉. 松嫩草地丛枝菌根真菌孢子多样性对施肥的响应[D]. 长春: 东北师范大学, 2016.
(  0) 0) |
| [11] |
冯固, 张福锁, 李晓林, 等. 丛枝菌根真菌在农业生产中的作用与调控[J]. 土壤学报, 2010, 47(5): 995-1004 (  0) 0) |
| [12] |
冯海艳, 冯固, 王敬国, 等. 植物磷营养状况对丛枝菌根真菌生长及代谢活性的调控[J]. 菌物系统, 2003, 22(4): 589-598 DOI:10.3969/j.issn.1672-6472.2003.04.016 (  0) 0) |
| [13] |
田慧, 盖京苹, 李晓林, 等. 农田土著丛枝菌根真菌群落特征和磷吸收作用研究进展[J]. 土壤通报, 2013, 44(6): 1512-1519 (  0) 0) |
| [14] |
Dodd J C, Boddington C L, Rodriguez A, et al. Mycelium of arbuscular mycorrhizal fungi (AMF) from different Genera: Form, function and detection[J]. Plant and Soil, 2000, 226(2): 131-151 DOI:10.1023/A:1026574828169 (  0) 0) |
| [15] |
张华, 孙纪全, 包玉英. 丛枝菌根真菌影响植物次生代谢产物的研究进展[J]. 农业生物技术学报, 2015, 23(8): 1093-1103 (  0) 0) |
| [16] |
Xu J, Liu S J, Song S R, et al. Arbuscular mycorrhizal fungi influence decomposition and the associated soil microbial community under different soil phosphorus availability[J]. Soil Biology and Biochemistry, 2018, 120: 181-190 (  0) 0) |
| [17] |
鲁如坤. 土壤农业化学分析方法[M].
中国农业科技出版社, 北京, 2000
(  0) 0) |
| [18] |
Lumini E, Orgiazzi A, Borriello R, et al. Disclosing arbuscular mycorrhizal fungal biodiversity in soil through a land-use gradient using a pyrosequencing approach[J]. Environmental Microbiology, 2010, 12(8): 2165-2179 (  0) 0) |
| [19] |
Lee J, Lee S S, Young J P W. Improved PCR primers for the detection and identification of arbuscular mycorrhizal fungi[J]. FEMS Microbiology Ecology, 2008, 65(2): 339-349 (  0) 0) |
| [20] |
赵昕, 阎秀峰. 丛枝菌根真菌对植物次生代谢的影响[J]. 植物生态学报, 2006, 30(3): 514-521 (  0) 0) |
| [21] |
冯有智, 张华勇, 陈瑞蕊, 等. 高通量基因测序研究长期不同施肥对我国北方潮土丛枝菌根真菌多样性的影响[C]//面向未来的土壤科学(中册)——中国土壤学会第十二次全国会员代表大会暨第九届海峡两岸土壤肥料学术交流研讨会论文集. 成都, 2012: 348–351.
(  0) 0) |
| [22] |
马玉颖, 张焕朝, 项兴佳, 等. 长期施肥对砂姜黑土丛枝菌根真菌群落的影响[J]. 应用生态学报, 2018, 29(10): 3398-3406 (  0) 0) |
| [23] |
张之为, 田永伟, 杨剑峰, 等. 内蒙古中部地区马铃薯根际和根系丛枝菌根真菌类群的多样性[J]. 微生物学通报, 2020, 47(3): 738-748 (  0) 0) |
| [24] |
陈梅梅, 陈保冬, 王新军, 等. 不同磷水平土壤接种丛枝菌根真菌对植物生长和养分吸收的影响[J]. 生态学报, 2009, 29(4): 1980-1986 (  0) 0) |
| [25] |
袁仁文, 刘琳, 张蕊, 等. 植物根际分泌物与土壤微生物互作关系的机制研究进展[J]. 中国农学通报, 2020, 36(2): 26-35 (  0) 0) |
| [26] |
Wang C, Zheng M M, Chen J, et al. Land-use change has a greater effect on soil diazotrophic community structure than the plant rhizosphere in acidic ferralsols in Southern China[J]. Plant and Soil, 2021, 462(1/2): 445-458 (  0) 0) |
| [27] |
赵慧敏. 丛枝菌根生理生态学研究进展[J]. 安徽农业科学, 2009, 37(4): 1460-1462 (  0) 0) |
| [28] |
薛壮壮, 冯童禹, 王超, 等. 土地利用方式对酸性红壤丛枝菌根真菌群落的影响[J]. 土壤, 2022, 54(4): 733-739 (  0) 0) |
| [29] |
Abbott L K, Robson A D. Formation of external hyphae in soil by four species of vesicular-arbuscular mycorrhizal fungi[J]. New Phytologist, 1985, 99(2): 245-255 (  0) 0) |
| [30] |
Gosling P, Hodge A, Goodlass G, et al. Arbuscular mycorrhizal fungi and organic farming[J]. Agriculture, Ecosystems & Environment, 2006, 113(1/2/3/4): 17-35 (  0) 0) |
| [31] |
王庆峰, 姜昕, 马鸣超, 等. 长期施用氮肥和磷肥对东北黑土丛枝菌根真菌群落组成的影响[J]. 中国农业科学, 2018, 51(17): 3315-3324 (  0) 0) |
| [32] |
Qin H, Lu K P, Strong P J, et al. Long-term fertilizer application effects on the soil, root arbuscular mycorrhizal fungi and community composition in rotation agriculture[J]. Applied Soil Ecology, 2015, 89: 35-43 (  0) 0) |
| [33] |
李桂龙, 李朋发, 吴萌, 等. 化肥配施有机肥对花生根际细菌群落结构及共存网络的影响[J]. 土壤, 2022, 54(3): 498-507 (  0) 0) |
2. University of Chinese Academy of Sciences, Beijing 100049, China
 2023, Vol. 55
2023, Vol. 55


