多环芳烃(PAHs)是一类在环境中普遍存在的具有致畸、致癌、致突变效应的芳香族化合物,其中,16种PAHs被美国环境保护署列为优先控制污染物[1-2]。由于其具有亲脂性、疏水性和难降解性,PAHs极易被土壤颗粒吸附并在土壤中累积,土壤已成为PAHs的重要蓄积库[3]。当前,土壤中PAHs污染问题普遍存在,对人体健康构成了严重威胁[4-5]。
经口摄入是土壤PAHs人体暴露的重要途径。低年龄段的幼儿具有高频率的手–口行为,极易将手上黏附的土壤PAHs摄入口中,其每日经口摄入土壤PAHs的量要远高于成人而更易受到PAHs的威胁[6]。依据现有的土壤污染风险评估技术导则或管控标准[7-8],经口摄入土壤PAHs的人体健康风险是基于土壤PAHs总量而评估的。然而,土壤中的PAHs并非都能解吸并被人体吸收进入血液循环,以污染物总量评估人体健康风险往往过于保守,导致土壤修复目标过于严格、修复成本过高[9]。
基于生物有效性,即在特定时间内化合物从环境介质中穿过生物膜进入生物体的量与环境介质中总量的比值[10],来评估场地中污染物的人体健康风险并制定修复目标值较为合理。使用幼猪、猴子、老鼠等动物模型是评估污染物生物有效性的有效方式[11],然而动物试验成本较高,且常伴随一系列伦理问题,导致动物试验无法大批量进行。为了解决该问题,欧美等国家提出以生物可给性代替生物有效性来对污染物进行人体健康风险评估。生物可给性是指不同介质中污染物在模拟胃肠液中的释放量与总量的比值,它包含了生物有效性和潜在的被利用能力,代表了污染物可能被人体吸收的最大程度[12-13]。
当前,土壤PAHs生物可给性的测定尚无统一标准,多种体外胃肠模拟方法被应用于土壤PAHs生物可给性的测定,模拟方法的土液比、胃肠相培养时间等差异会对结果造成较大影响,严重制约了经口摄入土壤PAHs的人体健康风险评估[11]。明确体外胃肠模拟法存在的问题并完善,对我国污染场地土壤污染风险评估与修复标准体系构建和完善、前瞻性科学管理等都具有重要意义。
1 土壤PAHs生物可给性测定的体外胃肠模拟方法早期的土壤PAHs生物可给性测定主要借鉴于成熟的重金属生物可给性测定方法,随后多种基于生理条件的土壤PAHs生物可给性测定方法逐步建立并沿用至今。随着人们对PAHs疏水性、肠道吸收影响的认知,基于生理条件的体外胃肠模拟法也在不断优化。整体而言,当前土壤PAHs生物可给性测定处于多方法并存与应用的状态,尚无统一标准。
1.1 基于生理条件的土壤PAHs生物可给性测定方法基于生理条件的土壤PAHs生物可给性测定方法在1996—2011年快速发展,主要包括生理原理提取法(Physiologically-based extraction test,PBET)[14]、德国标准化研究所法(Deutsches institut für normung,DIN)[11, 15]、荷兰国家公共卫生与环境研究所法(Dutch national institute for public health and the environment,RIVM)[16-18]、体外胃肠法(in vitro digestion model,IVD)[19]、人体肠道微生物生态模拟系统法(Simulator of the human intestinal microbial ecosystem,SHIME)[20-21]、进食条件下有机评估的人体模拟方法(Fed organic estimation human simulation test,FOREhST)[22]、添加结肠相的生理原理提取法(Colon extended physiologically based extraction test,CE-PBET)[23]以及标准的生物可给性测定法(Unified bioaccessibility method,UBM)[11, 24]。表 1列举了不同体外模拟方法的组成和理化条件等信息。不同模拟方法间差异较大,显著影响了土壤PAHs生物可给性的测定[11],增加了PAHs污染场地人体健康风险评估的不确定性。
|
|
表 1 不同体外模拟方法的组成和理化条件 Table 1 Composition and physicochemical conditions of different in vitro simulation methods |
PBET法最早是由Ruby等[14]为了测定铅和砷的生物可给性而建立的。该法模拟了胃相和小肠相,胃、肠相的土液比均为1∶100(m∶V)。其中酸性的胃相成分包括胃蛋白酶、柠檬酸和乳酸等成分。试验过程中,胃液在经过1 h振荡培养后,用NaHCO3调节pH至7,同时加入适量的胰酶和胆汁盐将其转变为肠液,此后再进行4 h的振荡培养。目前,该法已成功应用于城市功能区表层土壤和污水灌溉土样的PAHs生物可给性测定[25-27]。
1.1.2 DIN法该法最初是由Hack和Selenka[15]提出的,用于测定土壤中PAHs和多氯联苯的生物可给性。随后该法被德国标准研究院采纳,并作为土壤中有机和无机污染物生物可给性测定的标准方法。DIN法除在胃肠相的培养时间、pH和土液比方面与PBET法有所不同外,胃肠液的成分也差异较大。有研究表明,DIN法测定的土壤PAHs生物可给性结果明显高于PBET法测定的结果,这可能归因于胆汁、培养时间等因素的影响[11]。范婧婧等[28]用该法评估了4个典型污染场地土壤中荧蒽、芘、苯并[b]荧蒽、苯并[a]芘和茚并[1, 2, 3-cd]芘的生物可给性及人体健康风险,结果表明,苯并[b]荧蒽、苯并[a]芘和茚并[1, 2, 3-cd]芘基于生物可给性的经口摄入暴露量比基于总量计算的暴露量低1 ~ 2个数量级,3种PAHs的风险管控值明显提高。
1.1.3 RIVM法该法以荷兰国家公共卫生与环境研究所的荷兰语名称(Rijksinstituut voor Volksgezondheid en Milieu)来命名。RIVM法除模拟胃肠液外,还模拟了唾液组成,同时整个模拟过程又可分为禁食和进食状态[16, 29]。Pu等[30]应用该法模拟了禁食条件下土壤性质对菲的生物可给性影响,结果表明,土壤性质显著影响了菲的生物可给性,土壤有机质含量和黏粒含量越高,菲的生物可给性越低。Grøn等[18]利用该法研究了进食条件下丹麦土壤中苯并[a]芘和二苯并[a, h]蒽的生物可给性,结果表明,两种PAHs的生物可给性大小依赖于PAHs污染源和土壤性质的影响。
1.1.4 IVD法该法和以往研究者对砷的生物可给性研究方法相似[20],主要包括胃相和小肠相两部分,胃肠模拟较为简单。该法的胃液模拟仅通过调节体系的pH,胃液组分中无胃蛋白酶等成分,而小肠液则由NaHCO3、胆汁和胰酶组成。James等[19]采用IVD法测定了8种土壤中PAHs的生物可给性。
1.1.5 SHIME法SHIME法由Molly等[31]开发,模拟了人体胃肠微生物生态系统,主要由胃、小肠、升结肠、横结肠和降结肠组成,通过蠕动泵实现食物和胃肠液的转移。随后,Richard等[32]利用该反应器开发出SHIME法,通过对胃、十二指肠和结肠环境的模拟来测定土壤中PAHs的生物可给性。增加结肠相并引入肠道微生物是体外胃肠模拟方法的一个积极进展,因为食物在结肠中停留时间很长,污染物在肠道微生物的作用下可能会被降解,只测定母体化合物却不考虑其代谢产物可能会低估污染物的生物可给性[33]。然而,微生物产生的气味及相对复杂的操作限制了该方法的大规模应用[34]。
1.1.6 FOREhST法该方法是Cave等[22]参照RIVM法而建立的土壤PAHs生物可给性测定方法。该方法模拟了唾液、胃相和小肠相。有研究表明,食物中的脂质成分会扩大胃肠液中持久性有机污染物的溶解度,使得有机污染物进一步从土壤中释放出来[33]。因此,该方法仅考虑了人体进食状态,以获得PAHs生物可给性的最大值。当前,该法已成功应用于污染场地和生物修复后的污染场地土壤PAHs生物可给性测定[35-37]。然而,食物成分的添加也会对分析结果造成一定影响,因为排除脂质成分需要进行皂化处理,这导致肠液萃取后的PAHs回收率偏低[33]。
1.1.7 CE-PBET法基于食物在结肠中停留时间长、结肠自身能够吸收营养物质,且结肠中含有碳水化合物、胆汁盐等有助于PAHs释放的成分,Tilston等[23]在PBET法的基础上添加结肠相,并考虑了食物成分的影响而建立了CE-PBET法。与SHIME法不同的是,Tilston等[23]并没有在结肠相中引入肠道微生物,而是对结肠相培养时间进行了优化。研究发现,8 h的结肠培养为最佳培养时间,能够显著提高土壤PAHs生物可给性测定结果,而食物成分能够进一步提高测定结果。
1.1.8 UBM法UBM法是欧洲生物可给性研究小组在2011年建立的,用于测定重金属砷、镉、铅的生物可给性[24]。该方法在PAHs生物可给性测定方面应用较少。Zhang等[11]研究了UBM法在PAHs生物可给性测定方面和PBET、DIN、IVD及FOREhST法的差异,结果显示,UBM法的测定结果仅略高于IVD法的测定结果。
1.2 基于生理条件的体外胃肠模拟法的优化不同于重金属离子在胃肠模拟液中溶解度高,PAHs疏水性强,在胃肠模拟液中溶解度有限,其更倾向于分配到亲脂相中。尽管部分体外模拟方法考虑到了土液比、脂质成分对PAHs溶解度的贡献,然而这些方法却忽略了肠道吸收对土壤PAHs释放的影响。如图 1所示,若不考虑肠道吸收的影响,PAHs在肠液中的解吸在达到土壤–肠液界面平衡时停止;而如果考虑肠道吸收的影响,肠液中PAHs始终处于未平衡状态,这使得PAHs可以持续不断地从土壤中释放出来[38]。因此,基于生理条件的测定方法可能大大低估了实际土壤PAHs生物可给性。鉴于肠道吸收的重要性,研究者们在生理条件的基础上积极模拟肠道吸收(添加吸附材料或引入Caco-2模式细胞)以提高PAHs生物可给性的测定。
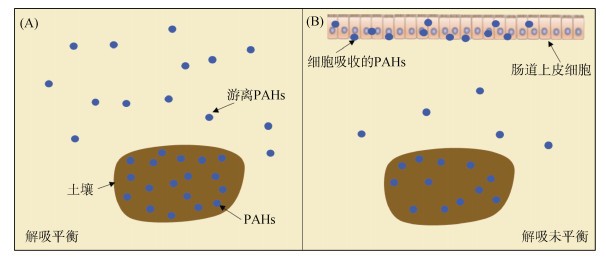
|
(A:未考虑肠道吸收的土壤PAHs解吸示意图;B:考虑肠道吸收的土壤PAHs解吸示意图) 图 1 肠液中土壤PAHs解吸示意图 Fig. 1 Schematic diagram of soil PAHs desorption in intestinal juice |
目前,应用于土壤PAHs生物可给性测定的吸附材料有C18膜、活性炭、聚二甲基硅氧烷(PDMS)和2, 6二苯呋喃多孔聚合物树脂(Tenax TA),通过对这些材料的反萃取可以得出土壤PAHs的生物可给性。James等[19]率先使用添加了C18膜的IVD法测定8种污染土中PAHs的生物可给性,结果显示,添加了C18膜的IVD法测得的生物可给性结果明显高于IVD法测得的结果,每克土壤PAHs释放量由6.6 ng苯并[a]芘当量增加到了290 ng苯并[a]芘当量。Collins等[39]利用PDMS对生物质炭进行固定化以形成一个“无穷尽的吸附汇”,并结合CE-PBET法验证吸附材料对PAHs生物可给性测定的必要性,结果表明,吸附材料能有效吸附PAHs,使田间土壤PAHs生物可给性测定结果提高1.2倍~ 2.8倍。当前,PDMS结合PBET或CE-PBET法对土壤PAHs生物可给性测定结果的提高也已经被证实,并应用于PAHs致癌风险评估[40-42]。此外,多项研究表明,Tenax TA的添加也可以显著提高PBET、DIN、IVD、FOREhST和UBM法的土壤PAHs生物可给性测定结果[11, 43]。
1.2.2 Caco-2模式细胞的引入利用生物学手段改进现有的体外胃肠模拟法也是提高土壤PAHs生物可给性测定的有效方式。由于难以从小肠分离上皮细胞并培养,通常使用模式细胞Caco-2来替代小肠上皮细胞。Caco-2细胞是人结肠癌上皮细胞,完全分化的Caco-2细胞结构和功能与人体小肠上皮细胞十分接近,常被用来研究药物的代谢转运[38, 44]。相较于吸附材料,Caco-2细胞的应用更具有现实意义,能更真实地模拟人体实际状态。然而,可能受限于Caco-2细胞培养周期较长、易受污染、成本高、环境研究者对Caco-2细胞了解不足等因素制约,其在土壤PAHs生物可给性方面的应用较少。有限的研究证实了该细胞的引入可以促进PAHs从土壤基质中进一步释放,基于生理条件的测定方法可能低估了土壤PAHs的生物可给性[45-46]。
2 体外模拟法面临的问题与建议近20多年来,土壤PAHs生物可给性的测定引起了广泛关注。但就测定方法而言,依旧没有一个统一的标准,整体处于多种基于生理条件的模拟法和改进的模拟法并存与应用的杂乱阶段。体外模拟法的生理条件、吸附材料的选择等因素造成了土壤PAHs生物可给性测定结果的不确定性,严重制约了污染场地土壤PAHs人体健康风险评估。
2.1 生理条件的不统一通过表 1可以看出,不同体外模拟方法在模拟的相、土液比、胃肠液成分及各成分的含量等方面差异较大。如PBET、DIN和IVD法模拟了胃和小肠,SHIME和CE-PBET法模拟了胃、小肠和结肠,而UBM、FOREhST和RIVM法模拟了唾液、胃和小肠。这些方法组成的差异会对可给性测定造成较大差异[11, 33]。综合近年来的研究,生理条件对土壤PAHs生物可给性测定的主要影响因素有土液比、胆汁、食物成分、模拟时间、结肠相、微生物。
由于PAHs的溶解度有限,因此改变土壤和胃肠液间的土液比以及脂溶性成分的添加能显著提高PAHs释放率[33]。Richard等[32]研究发现体外胃肠模拟法测得的生物可给性与土液比成对数关系。Tang等[25]指出胆汁可以通过表面张力的降低和胆汁–脂质胶束的形成来增加肠液中PAHs的溶解度。此外,有研究表明食物中的脂质成分也会提高PAHs的溶解度,提高其生物可给性测定结果[23]。
实际上,PAHs从土壤基质中解吸并在胃肠液中达到热力学平衡需要一定时间,有限的模拟时间不能保证PAHs从土壤基质中充分解吸[19, 47]。因此,体外模拟法中胃肠相的模拟时间十分重要,而唾液相培养时间短、土液比小,其对PAHs释放的影响反而不大[47]。研究表明,大约80% 的成年人进食后的1 h内食物会从胃部排空,2 h内食物会完全排空[14]。而对健康人正常膳食的粗略估计表明,小肠内50% 的食物会在2.5 ~ 3.4 h排空,最大排空时间为6 h[48-49]。而部分体外模拟方法的小肠培养时间仅为2 h,如RIVM、IVD和FOREhST法。Zhang等[11]比较了PBET、DIN、IVD、FOREhST和UBM法在测定PAHs生物可给性方面的差异,测定结果为DIN > PBET ≈ FOREhST > UBM > IVD。由于DIN法有最长培养时间(2 h胃相+ 6 h小肠相)和相对较高的胆汁浓度,因而其生物可给性测定结果最高;而IVD法培养时间短(2 h胃相+ 2 h小肠相)、胃肠组成最简单,其可给性测定结果最低。相较于其余4种方法,尽管FOREhST法中食物成分的添加可能促使PAHs从土壤基质中释放,但2 h的小肠培养时间限制了测定结果的大小。Zhang等[11]通过进一步的多元线性回归分析发现,胆汁和培养时间在生物可给性测定方面起着重要的作用。考虑到结肠相培养时间长、含有胆汁盐等成分,其在土壤PAHs生物可给性测定方面起到的作用也不容忽视。
SHIME法最大的优点是考虑了结肠相和肠道微生物。在人体胃肠道中,相较于胃和小肠,大肠中肠道微生物的种类和数量显著提高,微生物数量约为1011个/g,种类达1 000多种[10]。环境中的有机物不仅本身具有毒性,在胃肠道微生物的作用下还可能发生代谢,生成生物富集系数更高、毒性更大的代谢物[10]。Richard等[32]研究发现,大肠微生物能够将苯并[a]芘代谢为7-羟基苯并[a]芘。因此,在评估有机污染物对人体的健康风险时,应综合考虑污染物及其代谢产物的生物有效性。然而,PAHs种类众多,不同PAHs在肠道微生物作用下的代谢途径及标志性代谢产物的筛选是一个巨大挑战。
综上所述,体外模拟法的土液比、胆汁、食物成分、模拟时间、结肠相和微生物这些生理因素对测定结果起着重要作用。基于现有的模拟方法,在CE- PBET法的基础上引入肠道微生物似乎是一个可行的方案。
2.2 Caco-2模式细胞和吸附材料的普适性差体外模拟法的建立是为了能快速、准确评估土壤PAHs人体健康风险,这意味着模拟方法必须较为简便、周期短、能普及应用。尽管Caco-2模式细胞和小肠上皮细胞功能相似,但细胞培养周期较长、易受污染及培养条件的限制等因素制约了其在土壤PAHs生物可给性测定方面的应用。此外,考虑到体外模拟法可能需要引入肠道微生物,而肠道微生物和Caco-2细胞共培养需要的条件苛刻,无法普及[38],相比之下,吸附材料的选择可能更具有普适性。然而需要注意的是,当前土壤PAHs生物可给性研究只关注了吸附材料对PAHs的吸附性,而忽略了其和肠道吸收PAHs效率间的相关性。吸附效率过高依旧会导致污染场地PAHs修复目标过于保守,而吸附效率过低则会大大低估污染场地PAHs人体健康风险。Kang等[50]比较了Caco-2细胞和4种吸附材料(硅胶、乙烯–醋酸乙烯共聚物、Tenax TA和C18膜)对4种PAHs (菲、芘、荧蒽、苯并[a]芘)的吸附动力学参数,结果显示,硅胶和乙烯–醋酸乙烯共聚物具有模拟Caco-2细胞的潜力。然而,模拟Caco-2细胞对更多种类PAHs吸附的研究尚无报道。鉴于PAHs种类众多,单一材料可能仅满足几种PAHs的测试要求,尽管会增加测试的工作量,但选择适宜的能够最终满足16种PAHs生物可给性测定的2 ~ 3种材料似乎是一个解决方法。此外,考虑到肠道微生物对PAHs的代谢作用,吸附材料对标志性代谢产物的吸附也值得考虑。最后,为了满足体外模拟方法普适性的原则,吸附材料的选择应该具有低成本、易回收、可重复利用的特点。对于类似Tenax TA这种微米级材料,可以利用不锈钢筛网进行包裹,以便于回收与萃取PAHs[47]。
2.3 缺乏体内模型的验证事实上,体外胃肠模拟不等同于人体实际胃肠消化,因此模拟方法测定的结果与幼猪等活体动物试验数据间的相关性验证显得尤为重要。Juhasz等[42]利用不添加吸附汇的FOREhST法结合逸度模型评估了修复后的杂酚油污染土壤PAHs生物可给性与小鼠试验的相关性,研究发现,体外模拟法测得的结果比活体试验结果低2 000倍,该结果进一步表明了添加吸附材料的必要性。而James等[19]研究发现,C18膜和IVD法结合测得的土壤PAHs可给性结果与幼猪试验具有较好的相关性(R2 = 0.45)。通常r > 0.8被认为是强相关,< 0.3被认为没有相关性,而介于0.3 ~ 0.8之间是弱相关[51]。考虑到IVD法胃肠模拟简单、培养时间短,测得的生物可给性结果不如PBET法等[11],添加吸附材料的其余测定方法可能会得到更强的相关性。遗憾的是,没有更多的研究验证添加吸附材料的体外模拟方法和动物活体试验的相关性。
值得注意的是,PAHs进入土壤后存在“快”速和“慢”速两个不同的吸附过程,其在土壤组分间的吸附和分配作用会对其生物可给性测定有重要影响[33, 52-53]。通常认为土壤有机质的含量和组成(胡敏素、富里酸、胡敏酸)是影响PAHs环境行为的重要因素,而PAHs在土壤中“慢”过程持续时间很长,一直到土壤有机质的吸附能力耗尽[53]。PAHs在土壤环境中的行为还和自身性质有关,一般低环(2 ~ 3环)的PAHs容易通过挥发或生物降解途径损失,而高环(4 ~ 6环)的PAHs则相对稳定。此外,高分子量、低溶解性的PAHs与胡敏素结合能力比与富里酸和胡敏酸的结合力强,这些与胡敏素结合的PAHs生物有效性低,很难释放[53]。因此,在进行体内–体外模型相关性分析时,需要大量试验研究PAHs不同老化阶段和不同土壤理化性质对测定结果的影响,以验证体外模拟方法的普适性。
3 结论与展望体外模拟法的不统一、不确定性,严重影响了土壤PAHs人体健康风险的正确评估,标准化、普适性的体外模拟方法的构建已迫在眉睫。综合当前体外模拟法存在的问题,对标准化方法的构建提出以下几点建议:①体外模拟法需要充分考虑生理条件的影响,CE-PBET法包括食物成分,增加了结肠相,且整个模拟过程培养时间充足等,可能是一种比较适宜的体外模拟法,而在CE-PBET法的基础上引入肠道微生物更接近于人体实际环境模拟。②引入肠道微生物需要考虑微生物对PAHs的降解作用及毒性更强的代谢产物的产生。③需要结合Caco-2细胞筛选和肠道吸收PAHs及其代谢产物速率相似的吸附材料,且吸附材料需要满足经济性、可回收性和重复利用性。④需要通过大量不同老化时间和不同理化性质的场地污染土壤或人为污染土壤来验证体内–体外模型的相关性。⑤建议增加实验室内和实验室外的体外模拟方法的可重复性实验,以保证测定结果准确可靠。
总之,今后土壤PAHs生物可给性的研究需要从生理条件、吸附材料的选择、体内模型验证来综合考虑,以期能够建立一个标准的体外模拟方法,为我国污染场地土壤标准体系构建和完善、前瞻性科学管理提供科学依据。
| [1] |
李力, 陈明茹, 张久红, 等. 外源添加作物秸秆对PAHs污染土壤有机碳矿化和污染物降解的影响[J]. 土壤, 2022, 54(5): 1058-1063 (  0) 0) |
| [2] |
朱燕婕, 何艳, 徐建明. 不同还原条件下多环芳烃厌氧微生物降解研究: 基于文献计量的剖析[J]. 土壤学报, 2022, 59(6): 1574-1582 (  0) 0) |
| [3] |
Wilcke W. SYNOPSIS polycyclic aromatic hydrocarbons (PAHs) in soil—A review[J]. Journal of Plant Nutrition and Soil Science, 2000, 163(3): 229-248 DOI:10.1002/1522-2624(200006)163:3<229::AID-JPLN229>3.0.CO;2-6 (  0) 0) |
| [4] |
方文雯, 李晓宁, 吴仕希, 等. 腐殖酸对Mycobacterium sp. NJS-1降解芘的影响[J]. 土壤学报, 2023, 60(1): 164-174 (  0) 0) |
| [5] |
宋丽莹, 宋洋, 刘翠英. 活性炭对土壤中多环芳烃生物有效性的影响[J]. 土壤, 2022, 54(5): 1051-1057 (  0) 0) |
| [6] |
Ruby M V, Lowney Y W. Selective soil particle adherence to hands: Implications for understanding oral exposure to soil contaminants[J]. Environmental Science & Technology, 2012, 46(23): 12759-12771 (  0) 0) |
| [7] |
中华人民共和国生态环境部. 建设用地土壤污染风险评估技术导则: HJ 25.3—2019[S]. 北京: 中国环境科学出版社, 2019.
(  0) 0) |
| [8] |
生态环境部, 国家市场监督管理总局. 土壤环境质量建设用地土壤污染风险管控标准: GB 36600—2018[S]. 北京: 中国标准出版社, 2018.
(  0) 0) |
| [9] |
郭晓欣, 范婧婧, 周友亚, 等. 焦化场地典型多环芳烃类污染物精细化风险评估[J]. 生态毒理学报, 2021, 16(1): 155-164 (  0) 0) |
| [10] |
张东平, 余应新, 张帆, 等. 环境污染物对人体生物有效性测定的胃肠模拟研究现状[J]. 科学通报, 2008, 53(21): 2537-2545 DOI:10.3321/j.issn:0023-074X.2008.21.001 (  0) 0) |
| [11] |
Zhang S J, Li C, Li Y Z, et al. Bioaccessibility of PAHs in contaminated soils: Comparison of five in vitro methods with Tenax as a sorption sink[J]. Science of The Total Environment, 2017, 601/602: 968-974 DOI:10.1016/j.scitotenv.2017.05.234 (  0) 0) |
| [12] |
Semple K T, Doick K J, Jones K C, et al. Defining bioavailability and bioaccessibility of contaminated soil and sediment is complicated[J]. Environmental Science & Technology, 2004, 38(12): 228A-231A (  0) 0) |
| [13] |
United States Environmental Protection Agency (US EPA). Standard operating procedure for an in vitro bioaccessibility assay for lead and arsenic in soil[R]. Washington DC: US EPA, 2017.
(  0) 0) |
| [14] |
Ruby M V, Davis A, Schoof R, et al. Estimation of lead and arsenic bioavailability using a physiologically based extraction test[J]. Environmental Science & Technology, 1996, 30(2): 422-430 (  0) 0) |
| [15] |
Hack A, Selenka F. Mobilization of PAH and PCB from contaminated soil using a digestive tract model[J]. Toxicology Letters, 1996, 88(1/2/3): 199-210 (  0) 0) |
| [16] |
Sips A J A M, Bruil M A, Dobbe C J G, et al. Bioaccessibility of contaminants form ingested soil in humans[S]. 711701012, RIVM, 2001.
(  0) 0) |
| [17] |
Oomen A G, Rompelberg C J M, Bruil M A, et al. Development of an in vitro digestion model for estimating the bioaccessibility of soil contaminants[J]. Archives of Environmental Contamination and Toxicology, 2003, 44(3): 281-287 DOI:10.1007/s00244-002-1278-0 (  0) 0) |
| [18] |
Grøn C, Oomen A, Weyand E, et al. Bioaccessibility of PAH from Danish soils[J]. Journal of Environmental Science and Health Part A-Toxic/Hazardous Substances & Environmental Engineering, 2007, 42(9): 1233-1239 (  0) 0) |
| [19] |
James K, Peters R E, Laird B D, et al. Human exposure assessment: A case study of 8 PAH contaminated soils using in vitro digestors and the juvenile swine model[J]. Environmental Science & Technology, 2011, 45(10): 4586-4593 (  0) 0) |
| [20] |
Laird B D, Richard V D WT, Corriveau M C, et al. Gastrointestinal microbes increase arsenic bioaccessibility of ingested mine tailings using the simulator of the human intestinal microbial ecosystem[J]. Environmental Science & Technology, 2007, 41(15): 5542-5547 (  0) 0) |
| [21] |
Siciliano S D, Laird B D, Lemieux C L. Polycyclic aromatic hydrocarbons are enriched but bioaccessibility reduced in brownfield soils adhered to human hands[J]. Chemosphere, 2010, 80(9): 1101-1108 DOI:10.1016/j.chemosphere.2010.04.061 (  0) 0) |
| [22] |
Cave M R, Wragg J, Harrison I, et al. Comparison of batch mode and dynamic physiologically based bioaccessibility tests for PAHs in soil samples[J]. Environmental Science & Technology, 2010, 44(7): 2654-2660 (  0) 0) |
| [23] |
Tilston E L, Gibson G R, Collins C D. Colon extended physiologically based extraction test (CE-PBET) increases bioaccessibility of soil-bound PAH[J]. Environmental Science & Technology, 2011, 45(12): 5301-5308 (  0) 0) |
| [24] |
Wragg J, Cave M, Basta N, et al. An inter-laboratory trial of the unified BARGE bioaccessibility method for arsenic, cadmium and lead in soil[J]. Science of The Total Environment, 2011, 409(19): 4016-4030 (  0) 0) |
| [25] |
Tang X Y, Tang L, Zhu Y G, et al. Assessment of the bioaccessibility of polycyclic aromatic hydrocarbons in soils from Beijing using an in vitro test[J]. Environmental Pollution, 2006, 140(2): 279-285 DOI:10.1016/j.envpol.2005.07.010 (  0) 0) |
| [26] |
Khan S, Cao Q, Lin A J, et al. Concentrations and bioaccessibility of polycyclic aromatic hydrocarbons in wastewater-irrigated soil using in vitro gastrointestinal test[J]. Environmental Science and Pollution Research, 2008, 15(4): 344-353 DOI:10.1007/s11356-008-0004-5 (  0) 0) |
| [27] |
Lu M, Yuan D X, Lin Q M, et al. Assessment of the bioaccessibility of polycyclic aromatic hydrocarbons in topsoils from different urban functional areas using an in vitro gastrointestinal test[J]. Environmental Monitoring and Assessment, 2010, 166(1): 29-39 (  0) 0) |
| [28] |
范婧婧, 周友亚, 王淑萍, 等. 基于DIN测试的场地土壤PAHs生物可给性及健康风险研究[J]. 环境科学研究, 2020, 33(11): 2629-2638 (  0) 0) |
| [29] |
Versantvoort C H M, Kamp V D E, Rompelberg C J M. Development and applicability of an in vitro digestion model in assessing the bioaccessibility of contaminants from food[S]. 320102002, RIVM, 2004.
(  0) 0) |
| [30] |
Pu X Z, Lee L S, Galinsky R E, et al. Evaluation of a rat model versus a physiologically based extraction test for assessing phenanthrene bioavailability from soils[J]. Toxicological Sciences, 2004, 79(1): 10-17 DOI:10.1093/toxsci/kfh091 (  0) 0) |
| [31] |
Molly K, Vande Woestyne M, Verstraete W. Development of a 5-step multi-chamber reactor as a simulation of the human intestinal microbial ecosystem[J]. Applied Microbiology and Biotechnology, 1993, 39(2): 254-258 DOI:10.1007/BF00228615 (  0) 0) |
| [32] |
Richard V D W T, Verstraete W, Siciliano S D. Polycyclic aromatic hydrocarbon release from a soil matrix in the in vitro gastrointestinal tract[J]. Journal of Environmental Quality, 2004, 33(4): 1343-1353 DOI:10.2134/jeq2004.1343 (  0) 0) |
| [33] |
Cui X Y, Xiang P, He R W, et al. Advances in in vitro methods to evaluate oral bioaccessibility of PAHs and PBDEs in environmental matrices[J]. Chemosphere, 2016, 150: 378-389 DOI:10.1016/j.chemosphere.2016.02.041 (  0) 0) |
| [34] |
Yu Y X, Han S Y, Zhang D P, et al. Factors affecting the bioaccessibility of polybrominated diphenylethers in an in vitro digestion model[J]. Journal of Agricultural and Food Chemistry, 2009, 57(1): 133-139 DOI:10.1021/jf802659u (  0) 0) |
| [35] |
Juhasz A L, Weber J, Stevenson G, et al. In vivo measurement, in vitro estimation and fugacity prediction of PAH bioavailability in post-remediated creosote-contaminated soil[J]. Science of The Total Environment, 2014, 473/474: 147-154 DOI:10.1016/j.scitotenv.2013.12.031 (  0) 0) |
| [36] |
Lorenzi D, Entwistle J, Cave M, et al. The application of an in vitro gastrointestinal extraction to assess the oral bioaccessibility of polycyclic aromatic hydrocarbons in soils from a former industrial site[J]. Analytica Chimica Acta, 2012, 735: 54-61 DOI:10.1016/j.aca.2012.05.030 (  0) 0) |
| [37] |
Adetunde O T, Mills G A, Olayinka K O, et al. Bioaccessibility-based risk assessment of PAHs in soils from sites of different anthropogenic activities in Lagos, Nigeria using the fed organic estimation human simulation test method[J]. Soil and Sediment Contamination: an International Journal, 2018, 27(6): 501-512 DOI:10.1080/15320383.2018.1488239 (  0) 0) |
| [38] |
Chen X X, Cheng X Y, Meng H, et al. Past, present, and future perspectives on the assessment of bioavailability/bioaccessibility of polycyclic aromatic hydrocarbons: A 20-year systemic review based on scientific econometrics[J]. Science of The Total Environment, 2021, 774: 145585 DOI:10.1016/j.scitotenv.2021.145585 (  0) 0) |
| [39] |
Collins C D, Mosquera-Vazquez M, Gomez-Eyles J L, et al. Is there sufficient 'sink' in current bioaccessibility determinations of organic pollutants in soils?[J]. Environmental Pollution, 2013, 181: 128-132 DOI:10.1016/j.envpol.2013.05.053 (  0) 0) |
| [40] |
Gouliarmou V, Collins C D, Christiansen E, et al. Sorptive physiologically based extraction of contaminated solid matrices: Incorporating silicone rod as absorption sink for hydrophobic organic contaminants[J]. Environmental Science & Technology, 2013, 47(2): 941-948 (  0) 0) |
| [41] |
Umeh A C, Duan L C, Naidu R, et al. In vitro gastrointestinal mobilization and oral bioaccessibility of PAHs in contrasting soils and associated cancer risks: Focus on PAH nonextractable residues[J]. Environment International, 2019, 133(Pt A): 105186 (  0) 0) |
| [42] |
Juhasz A L, Tang W, Smith E. Using in vitro bioaccessibility to refine estimates of human exposure to PAHs via incidental soil ingestion[J]. Environmental Research, 2016, 145: 145-153 DOI:10.1016/j.envres.2015.12.001 (  0) 0) |
| [43] |
Li C, Cui X Y, Fan Y Y, et al. Tenax as sorption sink for in vitro bioaccessibility measurement of polycyclic aromatic hydrocarbons in soils[J]. Environmental Pollution, 2015, 196: 47-52 DOI:10.1016/j.envpol.2014.09.016 (  0) 0) |
| [44] |
陈宝婷, 陈举亮, 孙毅东, 等. 芒果苷在Caco-2细胞模型中转运机制的研究[J]. 中药新药与临床药理, 2022, 33(9): 1248-1253 (  0) 0) |
| [45] |
Vasiluk L, Pinto L J, Walji Z A, et al. Benzo[a]pyrene bioavailability from pristine soil and contaminated sediment assessed using two in vitro models[J]. Environmental Toxicology and Chemistry, 2007, 26(3): 387-393 DOI:10.1897/06-343R.1 (  0) 0) |
| [46] |
Wang B, Xue M, Lv Y, et al. Cell absorption induced desorption of hydrophobic organic contaminants from digested soil residue[J]. Chemosphere, 2011, 83(11): 1461-1466 DOI:10.1016/j.chemosphere.2011.03.008 (  0) 0) |
| [47] |
Collins C D, Craggs M, Garcia-Alcega S, et al. 'Towards a unified approach for the determination of the bioaccessibility of organic pollutants'[J]. Environment International, 2015, 78: 24-31 DOI:10.1016/j.envint.2015.02.005 (  0) 0) |
| [48] |
Malagelada J R, Robertson J S, Brown M L, et al. Intestinal transit of solid and liquid components of a meal in health[J]. Gastroenterology, 1984, 87(6): 1255-1263 DOI:10.1016/0016-5085(84)90190-2 (  0) 0) |
| [49] |
Kaus L C, Gillespie W R, Hussain A S, et al. The effect of in vivo dissolution, gastric emptying rate, and intestinal transit time on the peak concentration and area-under- the-curve of drugs with different gastrointestinal permeabilities[J]. Pharmaceutical Research, 1999, 16(2): 272-280 DOI:10.1023/A:1018836727001 (  0) 0) |
| [50] |
Kang Y, Zeng D Y, Man Y B, et al. Comparison of sorption kinetics of PAHs by sorptive sinks and caco-2 cell and the correlation between bioaccessibility and bioavailability of PAHs in indoor dust[J]. Science of The Total Environment, 2018, 645: 170-178 DOI:10.1016/j.scitotenv.2018.07.102 (  0) 0) |
| [51] |
Ma J C, Qin C, Waigi M G, et al. Functional group substitutions influence the binding of benzophenone-type UV filters with DNA[J]. Chemosphere, 2022, 299: 134490 (  0) 0) |
| [52] |
刘文静, 李广坡, 倪进治, 等. 土壤有机质组分中多环芳烃分配特征和生态风险[J]. 中国环境科学, 2020, 40(4): 1620-1627 (  0) 0) |
| [53] |
平立凤, 骆永明. 有机质对多环芳烃环境行为影响的研究进展[J]. 土壤, 2005, 37(4): 362-369 (  0) 0) |
 2023, Vol. 55
2023, Vol. 55


