2. 北京市生态环境保护科学研究院, 北京 100037;
3. 国家城市环境污染控制工程技术研究中心, 北京 100037;
4. 污染场地风险模拟与修复北京市重点实验室, 北京 100037
多环芳烃(PAHs)是一类持久性的有机污染物,是由有机物不充分燃烧产生的两个或两个以上苯环以角状、线状或簇状排列组合而成的化合物[1]。2014年发布的《全国土壤污染状况调查公报》[2]显示,我国PAHs点位超标率为1.4%,是仅次于滴滴涕的有机污染物。苯并[a]芘(BaP)作为PAHs中发现最早、分布较广的稠环芳烃,主要来自汽车尾气、燃煤、工业排放等人类活动[3],可通过大气沉降和地表径流汇聚于土壤,具有生态毒性和“三致”效应,不仅会破坏生态功能,改变土壤的物理化学性质[4],还被认为是皮肤癌的危险因素。近年来,BaP先后被列入优先控制化学品名录(第二批)[5]、2022年美国有毒物质和疾病登记局(ATSDR)优先控制污染物清单[6]和2023年《重点控制的土壤有毒有害物质名录(第一批)》(征求意见稿)[7],成为土壤污染中关注的重点。
2015年第21届联合国气候变化大会达成《巴黎协定》[8],提出将全球平均气温升高幅度控制在低于2℃以内。较为遗憾的是,虽然部分国家或地区的CO2排放量有所下降,但全球情况并不乐观[9]。全球变暖导致气温急速上升、冰川融化、半挥发性有机污染物的释放加速,对整个生态系统产生持续性的消极影响[10]。植物通过地表生物量吸收和根系作用实现碳固定,运用植物技术修复,1 t土壤平均仅释放–20 ~ 30 kg左右的CO2[11]。随着我国“双碳”目标的提出,植物修复技术更好地践行了绿色发展战略,是实现降碳、固碳这一重要目标的可行措施。2016年国家“土十条”颁布[12],污染场地修复问题引起了广泛关注。由于BaP的植物敏感性低且富集能力强,BaP的植物修复技术作为一种新兴的绿色技术,成为越来越多研究者探讨的焦点。
由此,本文基于BaP的生态毒性特征,梳理了植物对BaP直接吸收作用、根际作用、固定作用的修复机理,总结了植物修复的影响因素和强化措施,并结合“双碳”背景,提出了未来研究趋势和研究方向,以期为植物修复技术提供更好的实践支撑。
1 BaP的生态毒性特征 1.1 BaP的生物敏感性在进行土壤中BaP生物敏感性研究时,必须纳入考虑的受体包括地上高等植物、动物(以无脊椎动物为主)、微生物及微生物主导的生态过程。为了保证数据的可靠性和可操作性,通常会优先选择具有国家标准测试方法的物种,无相关国家标准方法的,优先考虑具备国际标准化组织(ISO)或经济合作与发展组织(OECD)毒性测试方法的物种或生态风险评估常用物种。目前,国际标准化组织、经济合作与发展组织、美国试验与材料学会(ASTM)及美国环保署(EPA)等陆续公布了41种标准生物毒性测试方法,基于国际标准化组织和经济合作与发展组织的方法,我国也先后制订了5种污染土壤生态毒理学和生物学测试标准化方法。通过对欧洲毒性数据库、美国毒性数据库和已发表的文献进行检索,共得到11条BaP的EC10值(即抑制10% 生物生长所对应的BaP的浓度)(表 1)。植物一般以生长速率、生物量、根伸长作为受试终点;动物以繁殖率和致死率作为终点;微生物以呼吸作用和硝化作用等作为终点[16]。对比发现,基于小麦生长速率的BaP的EC10为1 725 mg/kg,而基于微生物硝化作用的EC10为1.3 mg/kg,相差1 326倍。微生物作为一种指示生物,对BaP最为敏感;植物由于其耐受力强,对BaP表现出较差的敏感性。
|
|
表 1 BaP生态毒性数据 Table 1 Ecotoxicity data of BaP |
植物受到土壤中污染物的胁迫后,会产生一系列保护和解毒机制。通常情况下,植物对BaP的耐受性表现在2个方面:①BaP被植物吸收富集在植物体内,通过植物降解、植物挥发和植物提取作用进行去除;②植物通过根系固定和根际效应使自身免受危害。张灵巧等[17]研究了麦冬和青绿薹草在不同含量BaP污染土壤中的耐受性,发现这两种植物可以耐受30 mg/kg BaP的胁迫,生长3个月后均全部存活,且与对照组相比植株形态无显著差异。Gabriele等[18]提出了用紫花苜蓿对菲、芘、Cu复合污染土壤进行修复,发现100 mg/kg土壤中菲的去除率高达90% 以上,且苜蓿的生物量仅减少25%。Dominguez等[19]测试了98种禾本科植物,发现利用PCR扩增技术测量到的分解代谢基因的丰度在苏丹草中最高,原因是苏丹草可以富集土壤中的鞘氨醇单胞菌,这是一种较为高效的降解菌剂,可以加速BaP的降解。不同植物种类对BaP的耐受阈值存在差异,筛选高耐受性的植物具有现实意义。
2 BaP的植物修复技术去除土壤中BaP的现有技术包括物理化学修复和生物修复。传统的物理化学修复方法虽然非常有效,但是价格昂贵,会改变土壤结构,降低微生物活性,并导致植被因为缺少养分而枯竭[20]。而植物修复技术是利用植物和相关微生物固定或降解土壤中污染物的一种新兴绿色治理技术,具有成本低、经济可行、不产生二次污染、美学价值高等优点,可以在尽可能少干扰土壤的情况下完成降解,通常被考虑用于恢复中度污染的土壤[21]。植物修复的机制主要包括5种[22](图 1):一是植物提取,BaP被植物吸收并转移至地上的枝条部分,可通过定期收割的方式实现污染物从土壤中清除;二是植物挥发,污染物通过叶片蒸腾作用挥发至大气中,该过程受到植物种类、植物叶面积、环境湿度、温度等因素的影响;三是根际作用,植物根系释放的分泌物和酶可提高微生物活性,通过与根际微生物的共代谢作用促进植物生长或降解污染物;四是植物降解,植物通过代谢、矿化作用将BaP转化为无毒产物并转运到不同组织;五是植物固定,由于植物根系具有巨大的表面积,可通过根系的吸附作用将BaP固定,降低其流动性和生物可利用性。植物提取、植物挥发和植物降解属于植物吸收的一种,而植物固定和根际作用都要依赖于植物和微生物的共同作用。
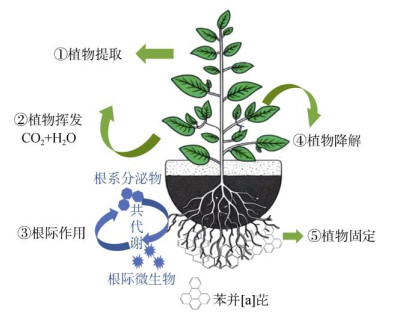
|
图 1 BaP植物修复机制 Fig. 1 Phytoremediation mechanism of BaP |
植物根系对有机物的吸收与其亲脂性有关,亲脂性较强的有机物更容易透过植物根部细胞膜或膜上的载体。BaP被根系吸收后,主要有3种去向[23-24]:通过木质部转运到植物的不同组织;被分解成没有毒性的中间代谢产物储存在植物体内;经过挥发、代谢和矿化作用转化成CO2和H2O等无机物,最终实现去除。
2.1.2 植物对BaP的根际作用根际微生物的降解被认为是BaP最主要和最有效的降解途径[25]。植物通过光合作用将产生的有机物释放到土壤中,促进土壤微生物活性,增加土壤有机质积累,提高固碳能力;植物根系分泌的黏性物质可以与土壤微粒结合,形成根黏附层,促进有机质的固定,减少碳流失[26]。研究表明,大约40% ~ 90% 的植物净固定碳转移至土壤,使得植物根处的微生物数量是未种植植物处微生物的72倍[27]。一方面,这些有机物为根际微生物提供大量的碳源和能源,促进微生物生长,增加微生物群落结构多样性[28];另一方面,由氨基酸、有机酸和糖类等产生的次级代谢产物,如异戊二烯、生物碱会诱导微生物体内分解代谢基因的表达,使植物可以抵御外界环境胁迫[29]。
2.1.3 植物对BaP的固定作用植物根系通常是指地下较为粗壮、对植物起固定作用的结构。根系细胞之间的空隙称为根毛带,这些根毛带可以扩大根的表面积,增加对BaP的吸附固定,减少土壤侵蚀、径流和淋滤作用的影响,利于土壤的长期稳定。尽管吸附固定后的BaP流动性降低,但要彻底去除,通常还需借助微生物来发挥作用。植物修复与微生物修复是紧密相关的,具体而言,在植物与微生物相互作用的过程中,会形成一定的共生关系,例如根瘤菌与陆地上大部分的豆科植物、丛枝菌根真菌(AMF)与部分维管植物等相互依赖,互利共生,在植物修复过程中发挥至关重要的作用[30]。Teng等[31]通过盆栽试验,研究了接种根瘤菌的紫花苜蓿对多氯联苯污染农业土壤植物修复的影响,发现对照组的降解率为37.2%,接种根瘤菌后达到了51.4%。
2.2 BaP植物修复影响因素 2.2.1 土壤理化性质植物对BaP的修复能力与土壤中微生物群落分布密切相关。土壤pH、有机碳、含水量和氧分压等理化性质是微生物活性的主要驱动因素,其通过影响微生物的活动间接影响植物修复效果[32]。土壤pH改变会影响与碳、氮和硫的生物地球化学循环相关的微生物过程;有机碳含量会影响土壤微粒对BaP的吸附;含水量会影响污染物的流动性和微生物的矿化速率[33]。Philippot等[32]从土壤水文、物理和化学的角度探讨了微生物群落与土壤特性之间的相互作用,Yavari等[34]探究了森林和农业两种不同土壤类型下菲的修复效果,揭示了复杂的微生物–土壤–植物关系。
2.2.2 BaP的生物化学特性植物修复很大程度上受到污染物理化性质如辛醇–水分配系数(logKow)、半衰期、分子量与分子结构等的影响[35]。研究发现,logKow在0.5 ~ 3之间的污染物最易被植物吸收降解[36]。BaP分子量高,logKow为6.06,具有较高的亲脂性和较强的抗降解能力。此外,BaP的半衰期较长,需要生物降解和氧化的时间更长,降解难度更大[37]。分子构象和苯环排列形式是影响植物修复的另一重要因素,蒽和菲属同分异构体,对含有蒽和菲污染的土壤进行植物修复时,发现菲浓度降低幅度相对较明显[38]。相比蒽和菲,BaP结构更为复杂,碳原子之间形成共轭体系,具有平面对称性和强稳定性,导致植物修复效果存在差异。
在复合污染的土壤中,存在多种污染物,污染物之间会发生显著的相互作用。宁婉彤[39]研究了BaP和Pb的联合毒性对黑麦草生长的影响,发现400 μmol/L Pb和40 μmol/L的BaP对黑麦草生物量降低表现协同作用;Song等[40]发现PAHs和Cd联合污染土壤对狗牙草的毒性远高于单独胁迫,表现出对细胞毒性的协同作用;Jeelani等[41]证明芘和高浓度Cd的相互作用会降低Cd的毒性作用。有机和无机污染物的结合最终会表现协同还是拮抗作用取决于污染物的性质、植物种类和污染物的浓度等因素。
2.2.3 植物种类在空气污染中,多会关注植物的叶片功能性状(气孔特征、角质层特性、毛状体等)[42]。在土壤污染中,植物生物量和叶片功能的各异性也同样重要。通过检索“土壤”“BaP”、“植物修复”等关键词,对过去研究的文献进行梳理,得到使用频率较高的几种BaP修复植物,分别是细草茅、地毯草、白三叶、苏丹草、苜蓿、东南景天和黑麦草。如图 2所示,不同植物种类在不同修复时间下表现出不同的修复效率。黑麦草和苏丹草修复15 d的效率即可达97.7% 和98.2%,东南景天修复120 d的效率仅为58.2%;随着修复时间的增加,植物的修复效率有所下降,可能原因是污染物浓度下降或植物对污染物的降解趋于饱和。禾本科类植物苜蓿和黑麦草被称为“固碳植物”;苜蓿单位叶面积固碳量为44.72 g/(m2·d),其不仅具有较大的叶面积,同时具有发达的根系,耐受性强、营养需求低,通常用于BaP植物修复的研究[43]。除上述几种植物外,在PAHs植物修复中,也会用到拟南芥、玉米、向日葵、香根草、芹菜和大麦等。Zheng等[44]利用90种芹菜对温室中PAHs污染的土壤进行原位修复,将根际耗散率与土壤酶和微生物群落进行Pearson相关分析,证明芹菜在农田修复和农业生产中具有广泛的应用前景。Sivaram等[45]对14种植物进行50 d的盆栽试验,发现PAHs的去除率为6% ~ 26%,其中香根草、玉米、向日葵的去除量最大。
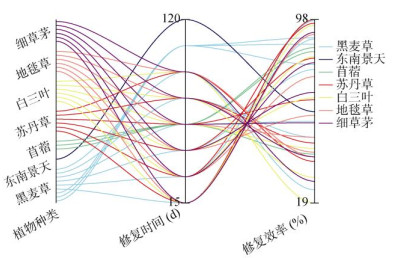
|
图 2 不同植物在不同修复时间下的修复效率 Fig. 2 Repair efficiencies of different plants under different repair time |
土壤的营养状况是影响植物修复效率的重要因素之一,尤其在一些土壤肥力低、盐度高的恶劣条件下。有研究表明,在高浓度高分子量PAHs污染的土壤中,植物修复的效果并不明显[29]。因此,改善土壤状况,向土壤中添加一些无机或有机改良剂非常必要,如表面活性剂可以增强BaP的表观溶解性及植物和微生物对BaP的吸收。另外,有学者向PAHs污染土壤中添加无机硒研究高效的植物修复体系,发现硒是一种很好地增强植物抗逆性和抗耐受性的土壤改良剂;PAHs会诱导产生大量的活性氧(ROS),ROS具有过氧化作用,会增加植物细胞膜的通透性,损害根细胞,进而抑制植物根系的生长[46]。硒作为一种抗氧化剂,可以使植物细胞免受ROS的伤害,降低芽和根当中的氧化应激指标;其他一些抗氧化系统如过氧化氢酶(CAT)和总超氧化物歧化酶(TSOD)可通过转化ROS来降低其危害,硒可以提高CAT和TSOD的酶活性[47]。这些结果为后续植物修复的研究提供了强有力的理论和实践支撑。
2.3.2 接种植物内生菌微生物辅助植物修复也是目前的重点研究方向之一。对于普通植物,根部可以直接吸收和储存3 ~ 4环的PAHs,而对于高环PAHs,植物的吸收能力有限。不管是一年生植物还是多年生植物,向其接种内生菌均可有效提高植物修复的效率,因为其可能在BaP的降解过程中发挥矿化作用[48]。内生菌是指可以生长在植物组织内但不会对宿主细胞产生任何负面影响的微生物[49]。不同的植物要选择合适的接种菌,Andreolli等[50]发现,芽孢杆菌(Burkholderia fungorum)DBT1是杂交杨树(白杨×黑杨)中最常见的内生菌,通过PCR扩增、DNA提取及对植物生长指标的分析,发现接种芽孢杆菌后污染物修复效率高达99%。Remans等[51]向拟南芥中接种了PGP细菌来处理2,4-二硝基甲苯,发现其表现出较高的ACC脱氨酶活性,极大地促进了植物根系的生长。
2.3.3 改进植物的栽培措施除了以上两种强化措施的影响,植物的密度及栽培方式也与植物修复效率息息相关。BaP通常情况下会聚集在植物根部,很难通过转运到达枝条和叶面。改变植物种植密度能够影响植物的生物量和根系参数如根系形态、根系生长和表面积等而影响植物修复效率[52]。植物种植密度越大,植物根系之间的竞争力越强,植物生长速率相对缓慢。从生态系统可持续性发展来看,降低种植密度是提高修复效率的一种选择[53]。另外,单一栽培和多物种联合种植对污染物的降解及大气碳储存量具有显著影响。Maila等[54]探讨了单作和多作植物的根际对污染物的降解情况,发现多物种种植的土壤中芴减少96%,单物种种植减少81%,对照组减少47%。Liu等[55]将5种草茅属的植物进行混种,土壤中芘、荧蒽、苯并[a]蒽等8种PAHs的降解率在培养150 d后高达99.4%。Yang等[56]研究了1、2、4、8以及16种植物多样性处理下的土壤年平均储碳(C)量,分别为(0.08±0.07)、(0.27±0.28)、(0.38±0.09)、(0.29±0.10)及(0.54±0.08)Mg/(hm2·a),在整个22年试验期间,2、4、8、16种植物多样性处理下,碳储存量分别增加60%、115%、115%、178%。
3 结论与展望根据污染物浓度及本地化的实际情况,选择合适的修复方式显得尤为重要。与土壤无脊椎动物和微生物相比,BaP对植物表现出较强的耐受性,植物根系分泌物和微生物的共代谢作用是BaP的主要降解途径。植物修复过程中,除了考虑BaP生物化学特性、土壤理化性质和植物种类等重要因素对修复效率的影响,也应关注一些强化措施(如添加土壤改良剂和接种植物内生菌)的结合,以此提高BaP的生物利用度和景观植物对其暴露的生长效应。
目前,BaP植物修复领域已经取得了一些研究成果,但尚需要关注现有研究的不足,开展今后的研究工作。
1) 通常情况下,在PAHs混合污染的土壤中,由于PAHs易氧化分子区域的存在以及其在植物体内流动性和水溶性的差异,会存在去除时间先后的问题,然而,如何将去除机理等化学机制与PAHs植物修复联系起来是一个需要进一步研究的问题。通过蛋白质组学分析确定植物分枝杆菌中与PAHs修复相关的蛋白质可能是鉴定这些生化机制的关键[57]。
2) 在未来的研究中,要寻找适合具有良好生化活性的本地植物种类,同时关注植物修复与物理化学修复手段的联合。Li等[58]利用植物根系对电压敏感的特点,采用电动辅助植物修复技术(EKPR)对菲和芘污染的土壤进行修复,发现电压周期为4 h时芘的去除率高达75.12%,证明适量的低电压可以改善污染物的去除情况。除此之外,植物修复技术与微生物修复技术密不可分,未来可研究土壤改良剂(如Se)对微生物的作用机制及其是否可以增强微生物对污染物的耐受性。
3) BaP在降解过程中,不可避免地会产生一些中间代谢产物或副产物(特别是含氧代谢物),其可能会表现出更大的发育毒性、诱变性或遗传毒性[59-60],由此会导致土壤中BaP的浓度与毒性之间不一定存在一致性[29]。因此,利用一些豆科植物和蚯蚓的生态毒理学试验评价植物修复后的污染物毒性可作为未来研究的重点方向之一。
4) BaP被植物吸收后,其在分子和细胞层面的降解机制尚不清楚。通常情况下,确定植物体内有机污染物浓度的方法是使用高效液相色谱和气相色谱,但这两种方法的成本较高、操作时间较长,因此,探索新的PAHs检测方法是国内未来研究需要考虑的方向之一。国外Alves等[61]已发现植物叶片中的腺体分泌毛状体(GST)能够发出典型颜色的荧光,可能是PAHs吸收和降解的位点,使用荧光显微镜和多光子显微镜可检测其迁移情况,同时根据荧光的大小和强度定量描述污染物的数量和浓度。
| [1] |
Franco S S, Nardocci A C, Günther W M R. PAH biomarkers for human health risk assessment: A review of the state-of-the-art[J]. Cadernos De Saude Publica, 2008, 24(Suppl 4): s569-s580 DOI:10.1590/S0102-311X2008001600009 (  0) 0) |
| [2] |
中华人民共和国环境保护部. 全国土壤污染状况调查公报[EB/OL]. (2014-04-17). https://www.mee.gov.cn/gkml/sthjbgw/qt/201404/t20140417_270670.htm.
(  0) 0) |
| [3] |
Ravindra K, Sokhi R, Vangrieken R. Atmospheric polycyclic aromatic hydrocarbons: Source attribution, emission factors and regulation[J]. Atmospheric Environment, 2008, 42(13): 2895-2921 DOI:10.1016/j.atmosenv.2007.12.010 (  0) 0) |
| [4] |
Nwoko C O. Effect of arbuscular mycorrhizal (AM) fungi on the physiological performance of Phaseolus vulgaris grown under crude oil contaminated soil[J]. Journal of Geoscience and Environment Protection, 2014, 2(4): 9-14 DOI:10.4236/gep.2014.24002 (  0) 0) |
| [5] |
中华人民共和国生态环境部. 优先控制化学品名录(第二批)[EB/OL]. (2020-10-30). https://www.mee.gov.cn/xxgk2018/xxgk/xxgk01/202011/t20201102_805937.html.
(  0) 0) |
| [6] |
Agency for Toxic Substances and Disease Registry. Substance priority list[EB/OL]. (2023-10-18). https://www.atsdr.cdc.gov/spl/.
(  0) 0) |
| [7] |
中华人民共和国生态环境部. 重点控制的土壤有毒有害物质名录(第一批)(征求意见稿)[EB/OL]. (2023-09-08). https://www.mee.gov.cn/xxgk2018/xxgk/xxgk06/202309/t20230908_1040452.html.
(  0) 0) |
| [8] |
United Nations Climate Change. The Paris agreement[EB/OL]. (2015-12-12). https://unfccc.int/process-and-meetings/the-paris-agreement.
(  0) 0) |
| [9] |
Schröder P, Herzig R, Bojinov B, et al. Bioenergy to save the world. Producing novel energy plants for growth on abandoned land[J]. Environmental Science and Pollution Research International, 2008, 15(3): 196-204 DOI:10.1065/espr2008.03.481 (  0) 0) |
| [10] |
Verheyen J, Stoks R. Shrinking body size and physiology contribute to geographic variation and the higher toxicity of pesticides in a warming world[J]. Environmental Science & Technology, 2019, 53(19): 11515-11523 (  0) 0) |
| [11] |
Cheung H Y, Ho M P, Lau K T, et al. Natural fibre-reinforced composites for bioengineering and environmental engineering applications[J]. Composites Part B: Engineering, 2009, 40(7): 655-663 DOI:10.1016/j.compositesb.2009.04.014 (  0) 0) |
| [12] |
中华人民共和国国务院. 土壤污染防治行动计划[EB/OL]. (2016-05-28). https://www.gov.cn/zhengce/content/2016-05/31/content_5078377.htm.
(  0) 0) |
| [13] |
张家乐, 赵龙, 郭军康, 等. 不同环数多环芳烃对土壤白符跳(Folsomia candida)的毒性差异[J]. 农业环境科学学报, 2021, 40(12): 2638–2646, 2584 DOI:10.11654/jaes.2021-0307 (  0) 0) |
| [14] |
丁克强, 骆永明, 刘世亮. 多环芳烃对土壤中小麦发育的生态毒性效应[J]. 南京工程学院学报(自然科学版), 2008(02): 52-56 (  0) 0) |
| [15] |
Cheng J J, Song J, Ding C F, et al. Ecotoxicity of benzo[a]pyrene assessed by soil microbial indicators[J]. Environmental Toxicology and Chemistry, 2014, 33(9): 1930-1936 DOI:10.1002/etc.2637 (  0) 0) |
| [16] |
邓欢, 郭光霞, 乔敏. 多环芳烃污染土壤毒性评价指标的研究进展[J]. 生态毒理学报, 2009, 4(1): 1-13 (  0) 0) |
| [17] |
张灵巧, 朱梦婷, 彭颖, 等. 麦冬和青绿薹草对土壤苯并[a]芘的去除率及叶片生理响应特征[J]. 西北植物学报, 2022, 42(7): 1198-1207 (  0) 0) |
| [18] |
Gabriele I, Bianco F, Race M, et al. Phytoremediation of PAH- and Cu-contaminated soil by Cannabis sativa L. : Preliminary experiments on a laboratory scale[J]. Sustainability, 2023, 15(3): 1852 DOI:10.3390/su15031852 (  0) 0) |
| [19] |
Dominguez J J A, Bacosa H P, Chien M F, et al. Enhanced degradation of polycyclic aromatic hydrocarbons (PAHs) in the rhizosphere of sudangrass (Sorghum × drummondii)[J]. Chemosphere, 2019, 234: 789-795 DOI:10.1016/j.chemosphere.2019.05.290 (  0) 0) |
| [20] |
Gan S, Lau E V, Ng H K. Remediation of soils contaminated with polycyclic aromatic hydrocarbons (PAHs)[J]. Journal of Hazardous Materials, 2009, 172(2-3): 532-549 DOI:10.1016/j.jhazmat.2009.07.118 (  0) 0) |
| [21] |
李婉怡, 於维维, 余琼阳, 等. 土壤重金属–有机物复合污染环境效应与修复技术研究进展[J]. 土壤, 2023, 55(3): 453-463 DOI:10.13758/j.cnki.tr.2023.03.001 (  0) 0) |
| [22] |
Timmis K N. Handbook of hydrocarbon and lipid microbiology[M].
Springer, Berlin, 2010: 1-4637
(  0) 0) |
| [23] |
Trapp S, Matthies M. Generic one-compartment model for uptake of organic chemicals by foliar vegetation[J]. Environmental Science & Technology, 1995, 29(9): 2333-2338 (  0) 0) |
| [24] |
Ansari F, Momina, Ahmad A, et al. Review on bioremediation technologies of polycyclic aromatic hydrocarbons (PAHs) from soil: Mechanisms and future perspective[J]. International Biodeterioration & Biodegradation, 2023, 179: 105582 (  0) 0) |
| [25] |
Li W M, Wang D S, Hu F, et al. Exogenous IAA treatment enhances phytoremediation of soil contaminated with phenanthrene by promoting soil enzyme activity and increasing microbial biomass[J]. Environmental Science and Pollution Research International, 2016, 23(11): 10656-10664 DOI:10.1007/s11356-016-6170-y (  0) 0) |
| [26] |
Hao M, Wang G F, Yu Q H, et al. The soil microbial necromass carbon and the carbon pool stability drive a stronge priming effect following vegetation restoration[J]. Journal of Environmental Management, 2024, 351: 119859 DOI:10.1016/j.jenvman.2023.119859 (  0) 0) |
| [27] |
Verâne J, Dos Santos N C P, da Silva V L, et al. Phytoremediation of polycyclic aromatic hydrocarbons (PAHs) in mangrove sediments using Rhizophora mangle[J]. Marine Pollution Bulletin, 2020, 160: 111687 DOI:10.1016/j.marpolbul.2020.111687 (  0) 0) |
| [28] |
刘贝贝, 陈歆, 陈淼, 等. 根系分泌物在土壤有机污染物降解中的作用[J]. 热带农业科学, 2013, 33(10): 47-52+55 (  0) 0) |
| [29] |
Cofield N, Schwab A P, Williams P, et al. Phytoremediation of polycyclic hydrocarbon contaminated soil: Part Ⅱ. Impact on ecotoxicity[J]. International Journal of Phytoremediation, 2007, 9(5): 371-384 DOI:10.1080/15226510701603866 (  0) 0) |
| [30] |
Rajtor M, Piotrowska-Seget Z. Prospects for arbuscular mycorrhizal fungi (AMF) to assist in phytoremediation of soil hydrocarbon contaminants[J]. Chemosphere, 2016, 162: 105-116 DOI:10.1016/j.chemosphere.2016.07.071 (  0) 0) |
| [31] |
Teng Y, Luo Y M, Sun X H, et al. Influence of arbuscular mycorrhiza and Rhizobium on phytoremediation by alfalfa of an agricultural soil contaminated with weathered PCBs: A field study[J]. International Journal of Phytoremediation, 2010, 12(5): 516-533 DOI:10.1080/15226510903353120 (  0) 0) |
| [32] |
Philippot L, Chenu C, Kappler A, et al. The interplay between microbial communities and soil properties[J]. Nature Reviews Microbiology, 2024, 22(4): 226-239 DOI:10.1038/s41579-023-00980-5 (  0) 0) |
| [33] |
刘琛, 郭彬, 林义成, 等. 丛枝菌根真菌对金叶六道木镉吸收及根际真菌群落结构的影响[J]. 土壤学报, 2021, 58(2): 495-504 (  0) 0) |
| [34] |
Yavari S, Malakahmad A, Sapari N B. A review on phytoremediation of crude oil spills[J]. Water Air and Soil Pollution, 2015, 226: 279 (  0) 0) |
| [35] |
Correa-García S, Rheault K, Tremblay J, et al. Soil characteristics constrain the response of microbial communities and associated hydrocarbon degradation genes during phytoremediation[J]. Applied and Environmental Microbiology, 2021, 87(2): e02170-e02120 (  0) 0) |
| [36] |
周际海, 袁颖红, 朱志保, 等. 土壤有机污染物生物修复技术研究进展[J]. 生态环境学报, 2015, 24(2): 343-351 (  0) 0) |
| [37] |
Zhu Z, Li L X, Yu Y N, et al. Distribution, source, risk and phytoremediation of polycyclic aromatic hydrocarbons (PAHs) in typical urban landscape waters recharged by reclaimed water[J]. Journal of Environmental Management, 2023, 330: 117214 (  0) 0) |
| [38] |
Aranda E, Scervino J M, Godoy P, et al. Role of arbuscular mycorrhizal fungus Rhizophagus custos in the dissipation of PAHs under root-organ culture conditions[J]. Environmental Pollution, 2013, 181: 182-189 (  0) 0) |
| [39] |
宁婉彤. Pb和B[a]P对黑麦草耐性及矿质营养吸收特征的研究[D]. 沈阳: 辽宁大学, 2021.
(  0) 0) |
| [40] |
Song X L, Li C J, Chen W F. Phytoremediation potential of Bermuda grass (Cynodon dactylon (L.) pers.) in soils co-contaminated with polycyclic aromatic hydrocarbons and cadmium[J]. Ecotoxicology and Environmental Safety, 2022, 234: 113389 (  0) 0) |
| [41] |
Jeelani N, Yang W, Qiao Y J, et al. Individual and combined effects of cadmium and polycyclic aromatic hydrocarbons on the phytoremediation potential of Xanthium sibiricum in co-contaminated soil[J]. International Journal of Phytoremediation, 2018, 20(8): 773-779 (  0) 0) |
| [42] |
Prigioniero A, Zuzolo D, Niinemets Ü, et al. Particulate matter and polycyclic aromatic hydrocarbon uptake in relation to leaf surface functional traits in Mediterranean evergreens: Potentials for air phytoremediation[J]. Journal of Hazardous Materials, 2022, 435: 129029 (  0) 0) |
| [43] |
Moreno-Barriga F, Díaz V, Acosta J A, et al. Organic matter dynamics, soil aggregation and microbial biomass and activity in Technosols created with metalliferous mine residues, biochar and marble waste[J]. Geoderma, 2017, 301: 19-29 (  0) 0) |
| [44] |
Zheng X H, Ding H, Xu X M, et al. In situ phytoremediation of polycyclic aromatic hydrocarbon-contaminated agricultural greenhouse soil using celery[J]. Environmental Technology, 2021, 42(21): 3329-3337 (  0) 0) |
| [45] |
Sivaram A K, Logeshwaran P, Lockington R, et al. Impact of plant photosystems in the remediation of benzo[a]pyrene and pyrene spiked soils[J]. Chemosphere, 2018, 193: 625-634 (  0) 0) |
| [46] |
Yao X Q, Chu J Z, He X L, et al. Effects of selenium on agronomical characters of winter wheat exposed to enhanced ultraviolet-B[J]. Ecotoxicology and Environmental Safety, 2013, 92: 320-326 (  0) 0) |
| [47] |
Xi Y, Liu H G, Johnson D, et al. Selenium enhances Conyza canadensis phytoremediation of polycyclic aromatic hydrocarbons in soil[J]. Journal of Soils and Sediments, 2019, 19(6): 2823-2835 (  0) 0) |
| [48] |
Barac T, Weyens N, Oeyen L, et al. Field note: Hydraulic containment of a BTEX plume using poplar trees[J]. International Journal of Phytoremediation, 2009, 11: 416-424 (  0) 0) |
| [49] |
Schulz B, Boyle C. What are endophytes?[M].
Springer, Berlin, 2006: 1-13
(  0) 0) |
| [50] |
Andreolli M, Lampis S, Poli M, et al. Endophytic Burkholderia fungorum DBT1 can improve phytoremediation efficiency of polycyclic aromatic hydrocarbons[J]. Chemosphere, 2013, 92(6): 688-694 (  0) 0) |
| [51] |
Remans T, Thijs S, Truyens S, et al. Understanding the development of roots exposed to contaminants and the potential of plant-associated bacteria for optimization of growth[J]. Annals of Botany, 2012, 110(2): 239-252 (  0) 0) |
| [52] |
Casper B B, Jackson R B. Plant competition underground[J]. Annual Review of Ecology and Systematics, 1997, 28: 545-570 (  0) 0) |
| [53] |
Liu H Y, Meng F B, Tong Y D, et al. Effect of plant density on phytoremediation of polycyclic aromatic hydrocarbons contaminated sediments with Vallisneria spiralis[J]. Ecological Engineering, 2014, 73: 380-385 (  0) 0) |
| [54] |
Maila M P, Randima P, Cloete T E. Multispecies and monoculture rhizoremediation of polycyclic aromatic hydrocarbons (PAHs) from the soil[J]. International Journal of Phytoremediation, 2005, 7(2): 87-98 (  0) 0) |
| [55] |
Liu R, Xiao N, Wei S H, et al. Rhizosphere effects of PAH-contaminated soil phytoremediation using a special plant named Fire Phoenix[J]. The Science of the Total Environment, 2014, 473/474: 350-358 (  0) 0) |
| [56] |
Yang Y, Tilman D, Furey G, et al. Soil carbon sequestration accelerated by restoration of grassland biodiversity[J]. Nature Communications, 2019, 10(1): 718 (  0) 0) |
| [57] |
Alves W S, Manoel E A, Santos N S, et al. Phytoremediation of polycyclic aromatic hydrocarbons (PAH) by cv. Crioula: A Brazilian alfalfa cultivar[J]. International Journal of Phytoremediation, 2018, 20(8): 747-755 (  0) 0) |
| [58] |
Li M, Huang Y P, Li K, et al. Enhancement of electrokinetic-phytoremediation by Ophiopogon japonicus: Stimulation of electrokinetic on root system and improvement of polycyclic aromatic hydrocarbon degradation[J]. Environmental Science and Pollution Research International, 2023, 30(43): 97591-97600 (  0) 0) |
| [59] |
Sleight T W, Sexton C N, Mpourmpakis G, et al. A classification model to identify direct-acting mutagenic polycyclic aromatic hydrocarbon transformation products[J]. Chemical Research in Toxicology, 2021, 34(11): 2273-2286 (  0) 0) |
| [60] |
Zeng J, Li Y, Dai Y, et al. Effects of polycyclic aromatic hydrocarbon structure on PAH mineralization and toxicity to soil microorganisms after oxidative bioremediation by laccase[J]. Environmental Pollution, 2021, 287: 117581 (  0) 0) |
| [61] |
Alves W S, Manoel E A, Santos N S, et al. Detection of polycyclic aromatic hydrocarbons (PAHs) in Medicago sativa L. by fluorescence microscopy[J]. Micron, 2017, 95: 23-30 (  0) 0) |
2. Beijing Municipal Research Institute of Eco-Environmental Protection, Beijing 100037, China;
3. National Engineering Research Centre of Urban Environmental Pollution Control, Beijing 100037, China;
4. Beijing Key Laboratory for Risk Modelling and Remediation of Contaminated Sites, Beijing 100037, China
 2024, Vol. 56
2024, Vol. 56


