2. 中国科学院大学, 北京 100049;
3. 南京农业大学资源与环境科学学院, 南京 210095;
4. 中国科学院应用生态研究所, 沈阳 110016;
5. 农业农村部环境保护科研监测所, 天津 300191
我国是农业大国,粮食产量巨大,每年生产超10 Gt的秸秆[1],其中水稻、小麦、玉米是主要农作物,同时也是农作物秸秆的主要来源。东北作为我国粮食主产区,每年贡献大量的农作物秸秆资源,但由于东北地区气温相对较低,秸秆还田后分解缓慢,不仅限制了农作物秸秆的综合利用和开发[2],而且影响作物的生根和成活,制约着东北黑土区的农业和环境可持续发展。
纤维素作为农作物秸秆的最主要成分,其复杂的分子结构是导致降解难度大的重要原因。目前已从自然界中筛选出许多纤维素降解菌株,其中真菌主要分布在木霉属[3]、青霉属[4]、曲霉属[5]等,细菌主要分布在芽孢杆菌属[6]、拟杆菌属[7]以及梭菌属[8]等。宁琪等[9]从长期施用有机肥的土壤中分离出两株被孢霉(Mortierella),在砂浆黑土中接种35 d后,两株菌对小麦秸秆的降解率均超过30%,展示出了较强的秸秆降解能力。邹芳等[10]在烟稻轮作田土壤中分化出一株纤维素降解活性较高的枯草芽孢杆菌(Bacillus subtilis)YC-2,7 d内降解了10.14% 的烟草秸秆,约为自然状态下的4.5倍,具有良好的田间应用潜力。
近年来,国内外关于纤维素降解菌筛选的报道主要集中在中高温条件下[11],低温纤维素降解菌的挖掘相对较少。在一些寒冷生境中,低温会显著降低微生物的活性,抑制微生物的代谢活动,包括酶的活性和生理特性的变化等[12],从而降低秸秆的降解速率。研究表明温度会影响在秸秆降解过程中的微生物群落[13-14],在低温条件下,微生物的活性较弱[15],难以在降解过程中发挥很好的作用,因此秸秆资源利用率一直未能得到较好的提升,所以寻找低温高效降解菌尤为重要。张恒芳等[16]从低温腐烂秸秆及土壤中筛选出一株纤维素降解能力较强的菌株A41,在12 ℃下发酵10 d,玉米秸秆降解率可达31.52%;董雪丽等[17]从腐化秸秆中分离出一株耐低温纤维素降解真菌JiTF01(Penicillium sp. JiTF01),在10 ℃下与水稻秸秆发酵21 d后,秸秆的降解率可达45.24%。纤维素的降解往往需要多种微生物的配合,因此随着研究的深入,也出现了可在低温条件下高效降解纤维素的复合菌系的筛选与构建。颜淑慧等[18]以高寒草原地区矿区土壤和可较好降解纤维素的菌剂为菌源,筛选出具有强纤维素降解能力的复合菌系MS15,在室内15 ℃的条件下培养15 d后,对纤维素类物质的降解率达到29.23%;路垚等[19]从土壤中分离出5株可在低温条件下降解纤维素的优势菌株,构建复合菌系,结果表明复合菌系2显示出了较强的纤维素降解能力,表现为在10 ℃、15 d液体培养中对秸秆的降解率达到了31.8%。
本研究以东北黑土为菌源,以玉米秸秆为降解底物,筛选能在15 ℃低温条件下高效降解纤维素的功能菌株,并构建复合菌系,为低温生境下秸秆资源利用挖掘更多的优势菌种资源。
1 材料与方法 1.1 试验材料 1.1.1 供试材料试验土壤采自中国科学院沈阳生态实验站(41°31′N,123°24′E)长期秸秆还田的试验地(免耕+100%玉米秸秆覆盖),小区面积8 m×15 m,土壤全碳含量11.05 g/kg,全氮含量9.42 g/kg。玉米秸秆烘干至恒重,挑选秸秆(不含叶),剪成长度为1~2 cm的小段备用。阳性对照菌株为中国典型培养物保藏中心节杆菌AS-3[20](分离自南极)。
1.1.2 培养基羧甲基纤维素(CMC)培养基:磷酸氢二钾2.5 g,磷酸氢二钠2.5 g,羧甲基纤维素钠20 g,蛋白胨2 g,酵母浸粉0.5 g,pH 7.2±0.2,蒸馏水1 L。刚果红鉴别培养基:硫酸铵2 g,七水合硫酸镁0.5 g,磷酸氢二钾1 g,氯化钠0.5 g,羧甲基纤维素钠2 g,琼脂20 g,蒸馏水1 L。LB培养基:胰蛋白胨10 g,酵母提取物5 g,氯化钠10 g,蒸馏水1 L。秸秆培养基:玉米秸秆5 g,胰蛋白胨10 g,酵母提取物5 g,氯化钠10 g,蒸馏水1 L。
1.2 试验方法 1.2.1 纤维素降解菌的筛选分离纯化:在采集的土壤样品中加入无菌生理盐水(10 g土,100 mL 0.85%生理盐水),放入摇床振荡(150 r/min,1 h),静置1 h,吸取上清液并用无菌水制备成10–6、10–5、10–4、10–3、10–2、10–1共6个稀释梯度的悬液,分别吸取100 µL的稀释液涂布在CMC固体培养基平板上,倒置,28 ℃恒温培养72 h。用一次性接种环挑取不同形态及颜色的单菌落进行纯化,传代两次。
刚果红试验:将单菌落挑至刚果红鉴别培养基平板上,倒置,28 ℃恒温培养72 h,测量透明圈及菌落的直径。
菌株保藏:将纯化后的单菌落接种至盛有CMC液体培养基的培养瓶中恒温振荡培养(28 ℃,120 r/min),于菌株对数生长期吸取1 mL菌液至装有1 mL 50% 甘油的冻存管中,–80 ℃保存。
1.2.2 耐低温纤维素降解菌的筛选验证为了探究优势菌株的生长耐受温度,设置4个温度梯度(20、15、10、4 ℃),将液体活化后的优势菌株在CMC固体培养基平板上分区划线,恒温培养(5~25 d),观察菌株在不同温度下的生长情况。
CMC酶活测定参照王琳等[21]的方法:从平板上挑选单菌落,放入LB液体培养基中,培养3 d (150 r/min,15 ℃)。用分光光度计测定OD600,用LB液体培养基调整至菌液的OD600= 0.6,室温下离心(4 000 r/min,10 min),上清液即为粗酶液。采用3, 5-二硝基水杨酸(DNS)比色法,以1% 羧甲基纤维素钠(CMC-Na)为底物进行酶活测定。该方法的反应原理为纤维素酶可以水解纤维素生成葡萄糖等还原糖,所生成的还原糖与DNS反应而生成橙色的3-氨基-5-硝基水杨酸,颜色深度与还原糖量相关,因而可通过测定还原糖量来表示纤维素酶的活性。
液体培养条件下秸秆降解率的测定:将单株菌株的菌液调至OD600=0.6,离心(8 000 r/min,10 min),无菌水洗脱3次后,将菌体用无菌水重悬,制备菌悬液。向20 mL秸秆培养基中加入1.2 mL菌悬液,恒温振荡培养30 d(150 r/min,15 ℃),培养结束将秸秆用蒸馏水进行清洗,80 ℃烘干至恒重,称重,计算失重率,试验设置3次重复。
1.2.3 菌株形态学、生理生化和遗传学鉴定形态学观察及生理生化特性检测参照《常见细菌系统鉴定手册》[22]。
菌株的系统发育分析:将菌株选取通用引物27F和1492R进行PCR扩增,扩增产物由生工生物工程(上海)有限公司进行测序,将测序得到的序列在NCBI (www.ncbi.nlm.nih.gov)上进行比对,并利用MEGA 11.0(www.megasoftware.net)软件构建系统发育树。
1.2.4 复合菌系的构建及功能验证将复筛得到的优势菌株与阳性对照菌株采用平板交叉划线的方式进行共培养,观察菌株之间是否拮抗,在可共存的前提下等比例进行复合菌系的构建。
液体培养条件下秸秆降解率的测定:将1.2 mL复合菌系的菌悬液(由单菌株的菌悬液各0.3 mL组成)接种至20 mL秸秆培养基中,15 ℃恒温振荡培养30 d,培养结束后将秸秆用蒸馏水进行清洗,80 ℃烘干至恒重,称重,计算失重率,试验设置3次重复。
埋袋试验测定秸秆降解率:为了模拟自然环境,试验所用的黑土以及玉米秸秆均未灭菌。在盛有等质量未灭菌黑土的50 mL玻璃试管中,用尼龙网袋包裹0.5 g玉米秸秆埋入15 cm处,加入1.2 mL菌悬液,15 ℃恒温静置培养30 d,培养结束后将秸秆用蒸馏水进行清洗,80 ℃烘干至恒重,称重,计算失重率,试验设置6次重复。
2 结果与分析 2.1 耐低温纤维素降解细菌的筛选利用CMC固体培养基共筛选出20株可降解纤维素的菌株,通过刚果红鉴别培养基进行初步筛选,发现有10株菌株产生了明显的透明圈(表 1,图 1),初步判断它们具有较强的纤维素降解能力。
|
|
表 1 纤维素降解菌株透明圈大小 Table 1 Transparent circle sizes of cellulose-degrading strains |
|
图 1 菌株刚果红鉴别结果 Fig. 1 Identification results of strain congo red |
在温度梯度试验中,菌株均可在15 ℃保持良好的生长情况,培养温度为10 ℃时,所有菌株生长受到延迟,培养温度为4 ℃时,除CN3以外,其他菌株生长受到明显抑制(表 2)。
|
|
表 2 不同温度下菌株生长情况 Table 2 Stain growth under different temperatures |
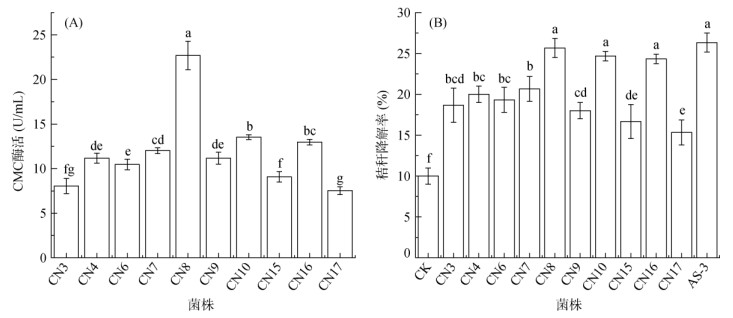
CMC酶活性测定结果显示CN8、CN10、CN16这3株优势菌的酶活性较高且与其他菌株之间存在显著差异(P<0.05),其中CN8的酶活性可达22.70 U/mL (图 2A)。另外,在液体培养条件下,CN8、CN10、CN16的秸秆降解率分别可达25.67%、24.67%、24.33%,秸秆降解率显著高于CK (P<0.05),且与阳性对照菌株之间不存在显著差异(图 2B)。由此可知,CN8、CN10、CN16为耐低温(15 ℃)纤维素降解优势菌。
|
(图中小写字母不同表示菌株间差异达P<0.05显著水平,下同) 图 2 单株菌株CMC酶活性(A)及液体培养条件下的秸秆降解率(B) Fig. 2 CMC enzyme activities of single strains (A) and straw degradation rates under liquid culture conditions (B) |
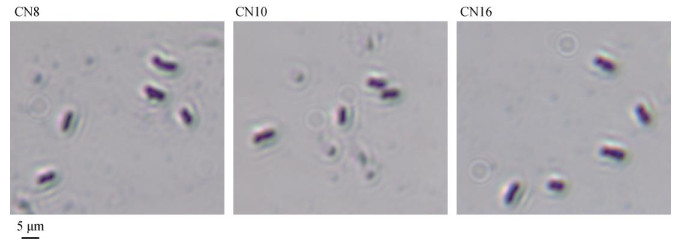
形态学观察:CN8菌落不透明,乳白色,圆形,表面不光滑,不隆起;CN10菌落透明,白色,椭圆形或圆形,表面不光滑,不隆起;CN16菌落不透明,乳白色,圆形,表面不光滑,不隆起。通过光学显微镜观察(图 3),3株优势菌的细胞形态均呈杆状。
|
图 3 菌株CN8、CN10、CN16显微镜形态学观察 Fig. 3 Microscopic morphological observations of CN8, CN10 and CN16 strains |
生理生化特性检测见表 3。3株优势菌革兰氏染色结果均呈阳性;除CN10甲基红实验显示阴性,CN8和CN16显示阳性外,3株优势菌的其他生理生化特性实验结果保持一致。
|
|
表 3 优势菌株生理生化特性检测 Table 3 Physiological and biochemical characteristics detection of dominant strains |
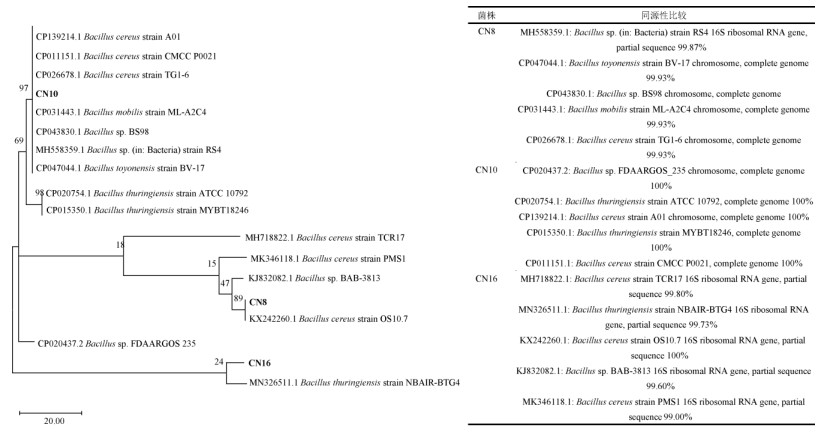
将菌株的16S rDNA序列在NCBI中进行Blast比对,选取同源性较高的序列利用MEGA 11.0构建系统发育树(图 4),经过分析,3株优势菌属于芽孢杆菌属,并且与比对菌株的16S rDNA相似性均高达99% 以上。
|
图 4 优势菌CN8、CN10、CN16系统发育树及同源性比对结果 Fig. 4 Phylogenetic tree of dominant bacteria CN8, CN10, CN16 and results of homology comparison |
综合菌株初筛及复筛的结果,将筛选到的CN8、CN10、CN16 3株优势菌与阳性对照菌株AS-3进行组合,构建复合菌系。组合方式如下:复合菌系A为CN8+CN10(1∶1),复合菌系B为CN8+CN16(1∶1),复合菌系C为CN10+CN16(1∶1),复合菌系D为CN8+CN10+CN16(1∶1∶1),复合菌系E为CN8+CN10+AS-3(1∶1∶1),复合菌系F为CN8+CN16+AS-3(1∶1∶1),复合菌系G为CN10+CN16+AS-3(1∶1∶1),复合菌系H为CN8+CN10+CN16+AS-3(1∶1∶1∶1)。
为了筛选耐低温高效降解纤维素复合菌系,对8种组合方式的复合菌系进行液体培养(15 ℃,30 d)下玉米秸秆降解率的测定。由图 5A可以看出,复合菌系的降解率均显著高于CK (P<0.05),其中复合菌系F降解效果最佳,降解率可达28.02%,与CK相比,降解率增幅为236.37%;其次为复合菌系D,对玉米秸秆的降解率达到了26.33%,是CK的3.16倍,并且与复合菌系F之间不存在显著差异。
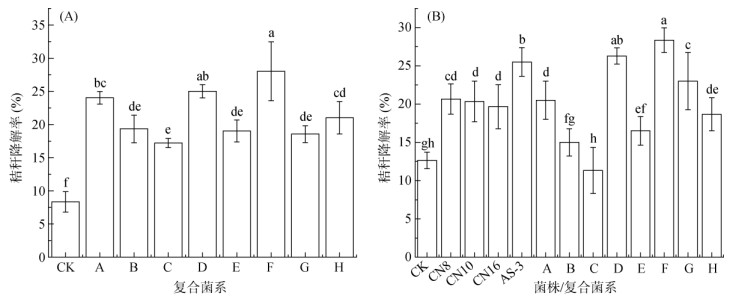
|
图 5 不同组合方式复合菌系在液体培养条件下(A)及埋袋试验(B)的秸秆降解率 Fig. 5 Straw degradation rates of different combinations under liquid culture conditions (A) and buried bag experiment (B) |
图 5B为埋袋试验(15 ℃恒温、培养30 d)下不同单菌株和复合菌系的玉米秸秆降解率。由图可知,复合菌系F的玉米秸秆降解率最高,为28.35%;其次为复合菌系D,秸秆降解率为26.27%;且均超过了阳性对照菌株AS-3(25.50%)。此外,复合菌系B、C、E以及H的降解率均低于单株优势菌株,甚至CK的降解效果好于复合菌系C,推测可能是由于黑土中存在的土著微生物影响了优势菌株的定殖、生长和功能,不同菌株之间的互作也会影响最终的降解效果。
综合两个降解试验结果,发现复合菌系D无论在液体培养条件下还是埋袋试验中,秸秆降解率均超过了单株优势菌株,且与阳性对照菌株以及包含阳性对照菌株组成的复合菌系之间降解效果差异并不显著,说明复合菌系D具有很强的纤维素降解能力。
3 讨论 3.1 耐低温纤维素降解菌的筛选耐低温纤维素降解菌的筛选是近年来生物质能源领域的重要研究方向之一,这类微生物通常进化出独特的生理和分子策略来适应低温环境[12],能够在较低温度下保持较高的活性并有效降解纤维素。因此,本研究对于处理寒冷地区或季节性低温条件下富含纤维素的农业废弃物、植物残体等生物质资源具有重要意义。
研究人员通常从寒冷环境如极地土壤[23]、冰川区[24]、冷季农田土壤[24]等富含纤维素且处于低温条件下的环境中采集样本,这些地方的微生物群落更可能含有耐低温并具有纤维素降解能力的菌株。传统筛菌方法是利用选择性培养基(如含纤维素为唯一碳源的培养基),在模拟低温条件下进行菌株的分离纯化和生长活性测试。通过观察菌落形态、生长速度及对纤维素的分解圈大小等方式初步筛选出潜在的耐低温纤维素降解菌,并利用分子生物学技术对菌株进行分类鉴定,后续通过研究菌株在不同低温条件下的生长动力学、适应机制及纤维素降解效率,评估其实际应用潜力。台少华[25]从低温地区土壤中筛选出一株近深绿木霉菌C47-3,在15 ℃、15 d的降解试验中,秸秆失重率可达23.89%;王靖然等[26]从蘑菇渣中筛选出一株耐冷秸秆降解细菌mgz-5,在16 ℃液体发酵30 d的条件下,玉米秸秆降解率达到28% 以上,经鉴定该菌株为鸡粪苍白杆菌(Ochrobactrum gallinifaecis sp.)。本试验以长期秸秆还田土壤为菌株来源,分离出10株可在15 ℃条件下具有良好生长状况的纤维素降解菌株,在复筛过程中,通过菌株CMC酶活性及液体培养条件下玉米秸秆降解率的测定,筛选出3株可在15 ℃条件下具有较强纤维素降解能力的优势菌株CN8、CN10、CN16,对玉米秸秆的降解率分别达到25.67%、24.67%、24.33%,并且均与阳性对照菌株之间不存在显著差异,经鉴定3株优势菌株均为芽孢杆菌属(Bacillus sp.)。
3.2 耐低温纤维素降解复合菌系的构建及功能验证耐低温纤维素降解复合菌系的研究在近年来取得了显著的成果,尤其是在环境适应性强、能够在低温条件下有效分解纤维素的微生物筛选和功能研究方面。这类菌系通常包含多种能够协同作用的菌株,每种微生物可能承担不同的功能角色,各自产生不同的酶类,如内切葡聚糖酶、外切葡聚糖酶、β-葡萄糖苷酶等,共同作用于纤维素分子链,实现其高效转化,从而提高整体的生物质转化效率。通过定向富集培养以及基于纤维素降解能力的选择性压力,对耐低温菌株进行筛选和优化。同时,采用生物化学方法和分子生物学技术评估复合菌系中各菌株的活性、稳定性以及它们在低温条件下的适应性和降解效率。陈世珩等[27]从污泥中分离出5株在15 ℃时纤维素降解能力强的菌株,分别为链霉菌(Streptomyces,AX1)、棘孢木霉(T.Asperellum,AX3)、钩状木霉(T.Asperellum,AM3)、曲霉(Aspergillus,AM4)和青霉(Penicillium,AM5),将可共存的菌株按照一定比例混合构建复合菌系,最终筛选出由AX1、AX3、AM4组成的复合菌系降解效果最佳,在15 ℃、30 d的培养条件下可降解32% 的纤维素;萨如拉等[28]从腐烂的树叶和高原锯末中筛选并构建出了一个复合菌系,包含青霉和多个细菌,15 ℃培养15 d,玉米秸秆减重率可达32.21%。此外虽然在很多情况下,复合菌系能够实现更高效的纤维素降解,但这并不是绝对的。复合菌系的降解效果也不一定好于单株菌株,例如Zhang等[15]从低温环境土壤中分离出3株纤维素酶活性较高的真菌,将其组合构建复合菌系并在培养基中进行15 ℃、30 d的静态玉米秸秆降解试验,结果发现复合菌系的降解率均低于单株优势菌株,主要是由于代谢作用的影响。在本试验的结果中也出现复合菌系效果差于单株菌株的情况,推测可能是由于黑土中存在的土著微生物影响了优势菌株的定殖、生长和功能。虽然构成复合菌系的单株优势菌之间不存在拮抗作用,但也会因为生长速度不同以及菌株之间的互作等原因影响最终的降解效果,因此应综合考虑菌株之间的相容性及协同作用,进行合理的配比及优化调控。
4 结论1) 从长期秸秆还田土壤中分离出3株纤维素降解能力较强的耐低温(15 ℃)细菌CN8、CN10和CN16,其中CN8的CMC酶活性可达22.70 U/mL,并在15 ℃、30 d的液体培养条件下对玉米秸秆的降解率达到25.67%。经鉴定3株菌株均为芽孢杆菌属(Bacillus sp.)。
2) 将3株优势菌CN8、CN10、CN16与阳性对照菌株AS-3在不存在拮抗作用的前提下等比例混合构建复合菌系,同时进行15 ℃、30 d的液体培养及埋袋法的秸秆降解试验,结果显示复合菌系D(CN8+ CN10+CN16)展示出了很强的降解能力,不仅与阳性对照菌株参与的复合菌系F(CN8+CN16+AS-3)之间无显著差异,而且在埋袋试验中降解率达到26.27%,也超过了单株阳性对照菌株AS-3(25.50%)。后续可以进一步对复合菌系D进行优化,从而更好地提升纤维素生物质转化为可再生能源或其他高价值产品的效率和经济性。
| [1] |
Fang Y R, Wu Y, Xie G H. Crop residue utilizations and potential for bioethanol production in China[J]. Renewable and Sustainable Energy Reviews, 2019, 113: 109288 DOI:10.1016/j.rser.2019.109288 (  0) 0) |
| [2] |
李辉. 东北地区农作物秸秆综合利用的现状及建议[J]. 农机使用与维修, 2022(7): 149-151 (  0) 0) |
| [3] |
张艳萍, 赵瑛, 张运晖. 玉米秸秆降解真菌的筛选鉴定[J]. 甘肃农业科技, 2022, 53(5): 55-59 (  0) 0) |
| [4] |
孟建宇, 杨帆, 冀锦华, 等. 大兴安岭森林土壤中纤维素降解真菌的分离及产酶条件优化[J]. 黑龙江畜牧兽医, 2020(17): 108–111, 120, 171 (  0) 0) |
| [5] |
Badran R A. Cellulolytic activity of some cellulose- decomposing fungi in salinized soils[J]. Acta Mycologica, 2014, 29(2): 245-251 DOI:10.5586/am.1994.024 (  0) 0) |
| [6] |
Padhan K, Patra R K, Sethi D, et al. Exploitation of cellulose degrading bacteria in bioconversion of agro- wastes[J]. Chemosphere, 2024, 347: 140654 DOI:10.1016/j.chemosphere.2023.140654 (  0) 0) |
| [7] |
王成. 堆肥过程N2O减排控制与木质纤维素降解微生物学机理研究[D]. 杭州: 浙江大学, 2014.
(  0) 0) |
| [8] |
陈林, 王禄山, 张怀强. 热纤梭菌高效降解木质纤维素过程的组学研究进展[J]. 微生物学报, 2014, 54(2): 121-128 (  0) 0) |
| [9] |
宁琪, 陈林, 李芳, 等. 被孢霉对土壤养分有效性和秸秆降解的影响[J]. 土壤学报, 2022, 59(1): 206-217 (  0) 0) |
| [10] |
邹芳, 赵娟, 雷燕萍, 等. 一株烟草秸秆降解菌的分离、鉴定及酶学性质研究[J]. 土壤, 2016, 48(5): 939-945 DOI:10.13758/j.cnki.tr.2016.05.015 (  0) 0) |
| [11] |
单建荣, 全鑫, 朱用哲, 等. 一株低温纤维素降解菌的筛选与产酶条件优化[J]. 生态学杂志, 2021, 40(4): 1128-1136 (  0) 0) |
| [12] |
韩宇杰, 常潇, 向海, 等. 秸秆低温降解的研究进展[J]. 动物营养学报, 2023, 35(6): 3528-3536 (  0) 0) |
| [13] |
Zhou G X, Zhang J B, Zhang C Z, et al. Effects of changes in straw chemical properties and alkaline soils on bacterial communities engaged in straw decomposition at different temperatures[J]. Scientific Reports, 2016, 6: 22186 (  0) 0) |
| [14] |
周桂香, 陈林, 张丛志, 等. 温度水分对秸秆降解微生物群落功能多样性影响[J]. 土壤, 2015, 47(5): 911-918 DOI:10.13758/j.cnki.tr.2015.05.016 (  0) 0) |
| [15] |
Zhang S, Shan D X, Liu X, et al. Cellulose-degrading strains: Their screeningand application to corn strawin low-temperature environments[J]. Polish Journal of Environmental Studies, 2018, 27(5): 2349-2355 (  0) 0) |
| [16] |
张恒芳, 李林, 史喜林, 等. 玉米秸秆低温纤维素分解菌的筛选及分解效果测定[J]. 玉米科学, 2013, 21(5): 147-150 (  0) 0) |
| [17] |
董雪丽, 季静, 张松皓, 等. 一株耐低温纤维素降解菌的发酵条件优化和秸秆降解研究[J]. 农业生物技术学报, 2022, 30(5): 978-989 (  0) 0) |
| [18] |
颜淑慧, 孟庆俊, 许瑞, 等. 耐低温纤维素降解复合菌系的筛选[J]. 环境科学研究, 2023, 36(7): 1404-1415 (  0) 0) |
| [19] |
路垚, 刘雅辉, 孙建平, 等. 耐低温降解纤维素菌株的筛选及复合菌系构建[J]. 安徽农业科学, 2022, 50(10): 6–10, 27 (  0) 0) |
| [20] |
杨明珠, 许欢欢, 郭传旭, 等. 堆肥低温启动菌剂的研制与效果评价[J]. 生态与农村环境学报, 2024, 40(1): 138-146 (  0) 0) |
| [21] |
王琳, 刘国生, 王林嵩, 等. DNS法测定纤维素酶活力最适条件研究[J]. 河南师范大学学报(自然科学版), 1998, 26(3): 69-72 (  0) 0) |
| [22] |
东秀珠, 蔡妙英. 常见细菌系统鉴定手册[M].
科学出版社, 北京, 2001
(  0) 0) |
| [23] |
Cho C Y, Han S R, Oh T J. Complete genome sequence of Pedobacter sp. PAMC26386 and their low temperature application in Arabinose-containing polysaccharides degradation[J]. Current Microbiology, 2021, 78(3): 944-953 (  0) 0) |
| [24] |
He Z G, Ding B P, Ali Q, et al. Screening and isolation of cold-adapted cellulose degrading bacterium: A candidate for straw degradation and De novo genome sequencing analysis[J]. Frontiers in Microbiology, 2023, 13: 1098723 (  0) 0) |
| [25] |
台少华. 低温秸秆降解木霉筛选及对秸秆降解中微生物群落的影响[D]. 济南: 山东建筑大学, 2023.
(  0) 0) |
| [26] |
一株秸秆降解耐冷细菌的分离及其主要生物活性[J]. 安徽农业科学, 2022, 50(8): 85-89 (  0) 0) |
| [27] |
耐低温降解玉米秸秆复合菌剂的构建及其降解效果评价[J]. 安徽农业科学, 2022, 50(4): 64-68 (  0) 0) |
| [28] |
玉米秸秆低温降解复合菌系的筛选[J]. 中国农业科学, 2013, 46(19): 4082-4090 (  0) 0) |
2. University of Chinese Academy of Sciences, Beijing 100049, China;
3. College of Resources and Environmental Sciences, Nanjing Agricultural University, Nanjing 210095, China;
4. Institute of Applied Ecology, Chinese Academy of Sciences, Shenyang 110016, China;
5. Agro-Environmental Protection Institute, Ministry of Agriculture and Rural Affairs, Tianjin 300191, China)
 2025, Vol. 57
2025, Vol. 57


