IPCC (政府间气候变化专门委员会)于2023年发布的第六次评估报告中指出:随着全球温室气体排放不断增加,全球气候变暖进程仍持续进行中[1]。气候变化会导致农田生态系统的结构和功能以及生物多样性发生变化,进而影响农田生态系统的稳定性[2]。因此,研究气候变化与农田土壤养分变化关系对于深刻认识农田生态系统在气候变化下的响应机制具有重要意义。
土壤团聚体是原生土壤颗粒与有机质凝聚胶结形成的土壤结构单元,其作为土壤结构的基本单位,是土壤有机质的主要依附场所[3]。土壤团聚体通过将土壤中生物与有机碳进行空间隔离对有机碳形成物理保护,其含量与粒径分布影响着有机碳的稳定与固存[4]。土壤微生物能矿化土壤中的稳定有机质,从而加速有机质的周转,同时释放可供植物和微生物生长所需的养分,从而影响团聚体的形成和稳定[5]。土壤团聚体能为微生物提供异质性的生境,并且大团聚体具有较大的孔隙结构,有利于水氧流动,对微生物的活动和代谢具有积极作用[6]。已有研究表明,气温变化会对土壤有机质积累、降解和周转产生影响,进而影响土壤团聚体的形成和稳定[7],但对于土壤团聚体与微生物之间的相互联系机制仍认识较少。尽管目前已有部分学者针对气候变化对土壤养分变化及微生物活性影响开展研究[8-9],但从团聚体尺度上看土壤中有机碳含量及微生物活性在不同团聚体粒级中的响应是否一致,目前还少有报道。
基于以上,本试验依托长期模拟大气CO2浓度和温度升高的开放式平台,以太湖地区典型的水稻土为研究对象,采集表层(0 ~ 20 cm) 原状土壤,利用湿筛法[10]对土壤团聚体进行分级,结合高温外热重铬酸钾氧化法测定土壤团聚体中有机碳含量,并利用荧光定量PCR技术测定微生物基因丰度,以期在团聚体尺度上揭示气候变化对稻田土壤有机碳分布以及微生物丰度的影响。
1 材料与方法 1.1 试验地概况与试验设计试验地位于江苏省常熟市古里镇(31°30′N,120°33′E),耕作方式为稻麦轮作。该区气候类型属于亚热带季风气候,年平均气温为16 ℃,年平均降水量1 100 mm。供试土壤类型为太湖地区典型乌栅土,试验起始耕层(0 ~ 20 cm)土壤pH为7.0,容重为1.2 g/cm3,有机碳为19.2 g/kg,全氮为1.6 g/kg。
开放式模拟气候变化试验平台建于2010年,共设置4个试验处理:正常CO2浓度和温度的对照处理(CK),大气CO2浓度升高至500 µmol/mol(CE)、作物冠层温度升高2℃(WA)以及大气CO2浓度和温度共同升高处理(CW),每个处理各设3个重复,共12个试验圈。试验圈为八边形构造,每个面积约45 m2。为了避免设备干扰,所有处理圈从外观上保持一致,CO2升高处理圈和对照圈中均安装了升温圈中的红外灯罩,升温处理圈和对照圈中均安装了CO2释放管。平台设计示意图如图 1所示。
|
图 1 开放式模拟气候变化试验平台示意图 Fig. 1 Photograph of open climate change simulation platform |
供试水稻品种为常优5号。在2023年11月水稻收割前一周采集耕层0 ~ 20 cm原状土样。每个试验圈随机采集6个土壤样品,去除植物残体及其他杂物后放入取样盒立即带回实验室,按照自然裂隙掰成约1 cm左右大小土块并均匀混合。为减少外界环境对土壤微生物造成干扰,土壤样品带回实验室后,一部分土样于48 h内完成团聚体分组,并对各粒级团聚体进行相关理化性质及微生物分析;另一部分未分级土样进行风干处理,用于测定土壤基础性质。
1.3 团聚体分组及其有机碳测定土壤团聚体粒径组分分离采用湿筛法[10]:将100 g按照自然裂隙掰成1 cm左右大小的土块,放置在由0.053、0.25、2 mm孔径组成的套筛顶处(2 mm),使土块全部浸入液面以下,静置30 min后用团粒结构仪(TPF-100)以30 r/min的速度进行筛分10 min。筛分结束后,将各粒径筛上的团聚体冲洗到烧杯中,分别获得 > 2 mm大团聚体、0.25 ~ 2 mm小团聚体,0.053 ~ 0.25 mm微团聚体和 < 0.053 mm粉黏粒。各粒级团聚体在60℃烘箱烘干并称重,得到各粒级团聚体含量(以质量分数表示)。然后测定各粒级团聚体有机碳含量,测定方法采用高温外热重铬酸钾氧化法。
此外,采用 > 0.25 mm团聚体的质量占比(R0.25,式(1))、平均重量直径(MWD,式(2))和几何平均直径(GMD,式(3))3个指标表示团聚体稳定性。各粒级团聚体对有机碳的贡献率(Ri)采用式(4)进行计算。
| $ R_{0.25}= \frac{{{m_{\text{r}}} > 0.25}}{{{m_{\text{T}}}}} $ | (1) |
式中:mr > 0.25为粒径 > 0.25 mm的团聚体质量(g);mT为团聚体的总质量(g)。
| $ \text{MWD}= \sum\limits_{i = 1}^n {{X_i}{W_i}} $ | (2) |
| $ \text{GMD}= \exp \left( {\frac{{\sum\limits_{i = 1}^n {{W_i}\ln {X_i}} }}{{\sum\limits_i^n {{W_i}} }}} \right)$ | (3) |
式中:Xi为i粒级团聚体的平均直径(mm);Wi为i粒级团聚体占总团聚体的质量分数(%)。
计算公式:
| $ R_i= \frac{{w{\text{(}}C{\text{1)}} \times w{\text{(}}A{\text{1)}}}}{{w{\text{(}}C{\text{2)}}}} \times 100$ | (4) |
式中:w(C1)为i粒级土壤团聚体中有机碳含量(g/kg);w(A1)为i粒级团聚体质量分数(%);w(C2)为该土壤总有机碳含量(g/kg)。
1.4 微生物丰度测定土壤各粒级团聚体中微生物丰度采用实时荧光定量PCR(qPCR)技术进行测定。使用土壤基因组DNA试剂盒(SPINeasy DNA Kit for Soil, MP Biomedicals, LLC)按照说明书步骤对土壤样品中DNA进行提取,利用1% 琼脂糖凝胶电泳检测提取的DNA质量。之后对细菌16S rRNA和真菌18S rRNA分别采用引物对F338/R518和ITS1F/ITS2R进行qPCR扩增。qPCR扩增采用20 μL反应体系:10 μL 2X Universal SYBR Green Fast qPCR Mix,10 μmol/L正反向引物各0.5 μL,DNA模板1 μL,8 μL无菌超纯水。每次扩增的qPCR产物通过2% 琼脂糖凝胶电泳验证产物的片段大小是否正确。本试验的标准曲线质粒稀释范围从10–1 ~ 10–8,扩增效率在98% ~ 105%,R2 > 0.98。细菌和真菌丰度以每克干土含有的基因拷贝数(copies/g)表示。
1.5 数据处理采用Excel 2022对数据进行初步处理,采用SPSS 22.0对团聚体分布及稳定性、有机碳分布、微生物丰度进行单因素方差分析,并利用Duncan法进行差异显著性检验。采用Origin Pro 2021软件绘图。
2 结果与分析 2.1 气候变化对土壤团聚体分布及稳定性的影响由表 1可知,供试水稻土中小团聚体和粉黏粒质量占比显著高于其他粒级团聚体(P < 0.05),而微团聚体质量占比最小。与CK处理相比,大气CO2浓度升高和气温升高均会导致大团聚体质量占比显著增加,而粉黏粒质量占比下降。同时,CE处理土壤团聚体稳定性指标R0.25、MWD和GMD较CK处理显著提高(P < 0.05),WA和CW处理团聚体稳定性指标也较CK处理有所提高,但差异未达显著水平。
|
|
表 1 气候变化条件下土壤团聚体分布和稳定性 Table 1 Distribution and stability of soil aggregates under climate changes |
供试水稻土有机碳主要分布在大团聚体(18.4% ~ 22.8%)、小团聚体(20.0% ~ 25.3%)和微团聚体中(20.2% ~ 23.5%),粉黏粒中有机碳比例显著低于其他粒级(P < 0.05,图 2)。在大团聚体和小团聚体粒级中,CE和CW处理中有机碳含量较CK处理显著提高(P < 0.05),WA处理中有机碳含量无明显变化。
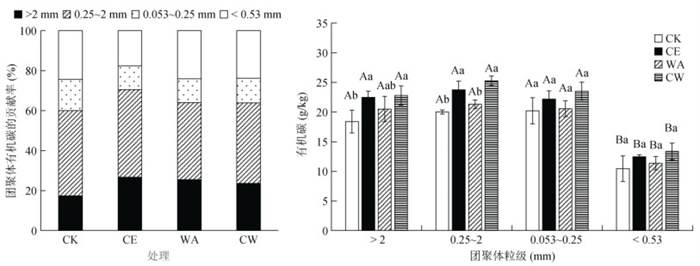
|
(柱图上方不同大写字母表示同一处理不同粒径团聚体间差异显著(P < 0.05),不同小写字母表示同一粒径团聚体在不同处理间差异显著(P < 0.05);下同) 图 2 气候变化条件下土壤团聚体有机碳及其对土壤总有机碳相对贡献 Fig. 2 Soil organic carbon in soil aggregates and their relative contributions to total soil organic carbon under climate changes |
不同气候变化处理中有机碳贡献率均呈现为小团聚体 > 大团聚体 > 粉黏粒 > 微团聚体,小团聚体有机碳贡献率最大,范围在38.6% ~ 43.8%。与CK处理相比,CE、WA和CW处理中大团聚体有机碳贡献率分别增加了9.3%、8.1% 和6.2%,微团聚体有机碳贡献率分别减少了3.8%、3.8% 和3.3%,粉黏粒有机碳贡献率分别减少6.7%、0.3% 和0.5%;CE处理中小团聚体有机碳贡献率增加了1.2%;WA和CW处理中小团聚体有机碳贡献率降低了0.3% 和0.5%。
2.3 气候变化对土壤团聚体微生物丰度的影响如图 3A可知,大气CO2浓度和温度升高对不同团聚体粒级中细菌丰度影响存在差异。在 > 2 mm大团聚体中,CE处理显著提高了细菌丰度(P < 0.05),而WA和CW处理对细菌丰度影响不显著;在0.25 ~ 2 mm小团聚体中,不同气候变化处理对细菌丰度均没有显著影响;但是在 < 0.25 mm微粉粒级中,CE、WA和CW处理中细菌丰度较CK处理显著提高(P < 0.05),增幅分别达83.7%、76.2% 和95.1%。
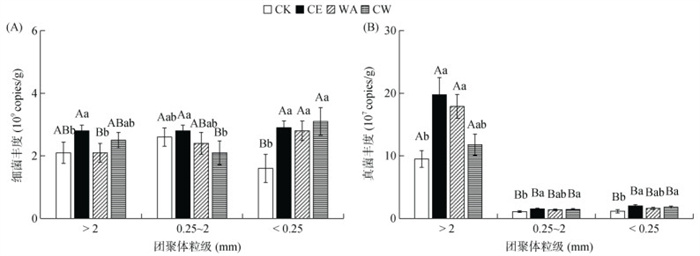
|
图 3 气候变化条件下土壤团聚体中细菌(A)和真菌(B)基因丰度 Fig. 3 Abundance of bacteria (A) and fungi (B) in soil aggregates under climate changes |
如图 3B可知,土壤真菌主要分布在 > 2 mm大团聚体中,显著高于0.25 ~ 2 mm小团聚体和 < 0.25 mm微粉粒级(P < 0.05)。与CK处理相比,CE处理中真菌丰度显著提高,在大团聚体、小团聚体和微粉粒级中分别提高了112.6%、36.6% 和81.4%;同时,WA和CW处理中真菌丰度也较CK处理稍有提高,在大团聚体、小团聚体和微粉粒级中分别提高了36.3% ~ 89.5%、27.3% ~ 34.3% 和45.5% ~ 63.6%。
2.4 土壤团聚体微生物丰度与平均重量直径和有机碳含量的相关性土壤团聚体微生物丰度与MWD和有机碳含量的相关性分析如图 4所示。土壤团聚体中细菌丰度与MWD极显著正相关(P < 0.01),真菌丰度与MWD、有机碳含量显著正相关(P < 0.05)。
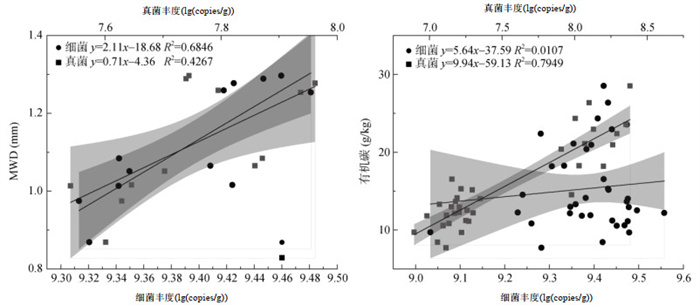
|
(图中阴影部分表示95%置信区间) 图 4 团聚体微生物丰度与团聚体平均重量直径(A)和有机碳含量(B)的相关关系 Fig. 4 Correlations of microbial abundance with mean weight diameter (A) and soil organic carbon content (B) of aggregates |
土壤团聚体作为作物高产量所需土壤肥力的物质基础,其数量和质量可反映土壤结构稳定性和养分供储能力[11]。水稳性团聚体中大团聚体比例、MWD、GMD指标反映团聚体粒径分布的总体状况,其值越大表示团聚体的稳定性和团聚度越强[12]。本试验采集的土壤样品中小团聚体比例显著高于其他粒级团聚体,土壤结构较稳定。研究表明,长期的作物种植对土壤团粒组织具有聚合效果[10]。本试验所选取的农田土壤长期耕作水稻、小麦,作物根系分泌物有利于促进土壤团聚体聚合,从而促进土壤结构稳定性。本研究发现,CO2浓度升高显著提高了水稻土团聚体稳定性(表 1)。大气CO2浓度升高会导致光合产物向植物根系分配,植物根系分配的碳量增加,可能会提高植物根系周转速率和根系分泌等过程的碳流量,从而提高土壤的碳固定量[13]。土壤有机物质增加能够在土壤中发挥胶结作用,促进团聚体的形成,提升大团聚体含量[14]。土壤中有机碳输入量增加会导致土壤微生物活性增加[15],土壤微生物菌丝能将土壤颗粒胶结在一起,促进团聚体形成[16]。陈书涛等[17]研究表明,温度升高会提高土壤微生物的活性并加速有机碳的分解。温度升高加速有机质的分解,从而加快大团聚体的周转,促使大团聚体向微小团聚体转化[18]。但在不同的增温方式和农田管理措施下,研究的结果也不尽相同。在熊丽[19]的研究结果中,增温提高了大团聚体的质量分数。在本研究中,升温处理显著增加了 > 2 mm大团聚体的质量占比(P < 0.05),MWD和GMD指数也略有增加,而大气CO2浓度和温度同时升高对土壤团聚体稳定性没有显著影响,这表明大气CO2浓度升高与温度升高对水稻土团聚体稳定性具有交互作用,升温能够减弱CO2浓度升高对团聚体稳定性的促进作用。
土壤有机碳作为陆地生态系统最重要和最活跃的碳库,其稳定性对维持全球碳平衡具有重要意义[20]。有研究发现,土壤团聚体与土壤有机碳之间的相关性十分密切[21]。本研究中,有机碳主要分布在 > 0.053 mm团聚体中,并且随着粒级减小,有机碳含量也随之减小,< 0.053 mm粉黏粒中有机碳含量显著低于其他粒级团聚体有机碳含量(图 2)。土壤有机碳可以作为一种重要的胶结物质,与矿物颗粒相互胶结形成微团聚体,微团聚体在胶结物质的作用下能发育成更大的团聚体,导致大团聚体中有机碳含量更高[22]。大气CO2浓度单独升高及其与温度升高的交互作用均能显著提高土壤团聚体中有机碳含量(P < 0.05),这与前人的研究结果一致,如刘芙蓉等[23]对川西亚高山针叶林土壤的研究表明,CO2浓度单独升高以及CO2浓度升高与温度升高交互作用均能提高土壤中可溶性有机碳含量。这主要是因为CO2浓度升高一方面能够影响植物地上和地下生物量,加速植物根系周转,促进土壤中碳、氮循环;另一方面促进了土壤微生物群落对自身养分的代谢以及对土壤有机物的分解。本研究中,升温处理中大团聚体有机碳贡献率较CK处理增加8.10%,这可能是因为温度升高能够促进植物生长,从而导致植物根系分泌量增加,致使土壤中有机物质优先进入大团聚体中[24]。
大气CO2浓度和温度升高通过影响土壤理化性质来影响微生物数量,从而改变土壤微生物基因丰度[9]。大气CO2浓度升高能够通过增加根系分泌物及根系沉积物导致土壤中碳输入增加,从而促进土壤微生物生长[15]。本研究发现,升温(WA)处理对 > 0.25 mm粒级团聚体中细菌丰度无显著性影响,但是显著提高真菌丰度。温度升高能够提高土壤中可溶性有机碳含量,从而增加微生物代谢活性。不同微生物类群对于温度升高的响应不同,相较于细菌,真菌具有更强的竞争优势,在养分竞争中能获取更多的养分从而促进自身繁殖[19]。气候条件及生态系统的不同也可能会导致升温对微生物群落结构的影响出现差异。Frey等[25]关于长期温度升高对微生物影响的研究表明,温度升高显著降低真菌丰度,从而导致微生物中碳存储量减少。Hayden等[26]研究表明,在升温条件下,草地土壤细菌丰度无明显变化。本研究中,CO2浓度升高与温度升高交互作用在不同粒级团聚体中存在明显差异,温度升高会减弱大气CO2浓度升高对土壤微生物丰度的促进效应(图 3),这表明大气CO2浓度升高与温度升高对土壤团聚体微生物丰度效应相互影响、相互制约[8-9]。
不同粒径团聚体间的养分、水分和空气等差异较大,导致土壤团聚体中微生物分布差异较大[19]。本研究中,土壤真菌在 > 2 mm团聚体中基因丰度显著高于其他粒级团聚体,团聚体中真菌丰度与MWD呈显著正相关(图 4A),这与前人的研究结果较一致,如蒋雪洋等[27]研究发现,MWD与大团聚体比例、有机碳含量、真菌和丛枝菌根真菌丰度呈极显著正相关。这是因为大团聚体中具有较大孔隙结构,有利于真菌菌丝的伸长,且大团聚体中富集的木质素和半纤维素有机物可供真菌的胞外酶有效利用,因此真菌往往聚集于大团聚体中[28]。本研究还发现,细菌在各粒级团聚体中分布较均匀,且细菌丰度与MWD呈显著正相关,与李景等[29]研究结果较一致。同时,真菌丰度与有机碳含量呈显著正相关(图 4B),表明大气CO2浓度升高通过影响有机碳含量变化进而促进土壤真菌数量增加。
4 结论1) 气候变化处理均增加了表层土壤中大团聚体占比,减少了粉黏粒质量占比;大气CO2浓度升高增加了土壤团聚体中有机碳含量,尤其在大团聚体中差异达显著水平,同时提高了土壤团聚体稳定性。
2) 土壤有机碳在大团聚体中比例(R0.25)显著高于其他粒级,有机碳贡献率在不同粒级团聚体中呈现小团聚体 > 大团聚体 > 粉黏粒 > 微团聚体;气候变化处理改变了不同粒级团聚体中有机碳贡献率。
3) 真菌主要分布在大团聚体中,细菌在各粒级团聚体中分布较均匀。团聚体细菌、真菌丰度均与MWD呈显著正相关,表明土壤微生物丰度与团聚体稳定性呈显著正相关。不同气候变化处理对各粒径团聚体中微生物丰度影响不同,表明土壤团聚体是影响土壤微生物群落分布的重要因素。
| [1] |
IPCC. Climate change 2023: Contribution of Working Groups Ⅰ, Ⅱ and Ⅲ to the sixth assessment report of the intergovernmental panel on climate change[R]. Geneva, Switzerland, IPCC, 2023: 1–34.
(  0) 0) |
| [2] |
肖国举, 张强, 王静. 全球气候变化对农业生态系统的影响研究进展[J]. 应用生态学报, 2007, 18(8): 1877-1885 (  0) 0) |
| [3] |
Atere C T, Gunina A, Zhu Z K, et al. Organic matter stabilization in aggregates and density fractions in paddy soil depending on long-term fertilization: Tracing of pathways by 13C natural abundance[J]. Soil Biology and Biochemistry, 2020, 149: 107931 (  0) 0) |
| [4] |
Wang X Y, Bian Q, Jiang Y J, et al. Organic amendments drive shifts in microbial community structure and keystone taxa which increase C mineralization across aggregate size classes[J]. Soil Biology and Biochemistry, 2021, 153: 108062 (  0) 0) |
| [5] |
李娜, 韩晓增, 尤孟阳, 等. 土壤团聚体与微生物相互作用研究[J]. 生态环境学报, 2013, 22(9): 1625-1632 (  0) 0) |
| [6] |
Six J, Conant R T, Paul E A, et al. Stabilization mechanisms of soil organic matter: Implications for C-saturation of soils[J]. Plant and Soil, 2002, 241(2): 155-176 (  0) 0) |
| [7] |
王清奎, 汪思龙. 土壤团聚体形成与稳定机制及影响因素[J]. 土壤通报, 2005, 36(3): 415-421 (  0) 0) |
| [8] |
刘远, 潘根兴, 张辉, 等. 大气CO2浓度和温度升高对麦田土壤呼吸和酶活性的影响[J]. 农业环境科学学报, 2017, 36(8): 1484-1491 (  0) 0) |
| [9] |
刘远, 张辉, 熊明华, 等. 气候变化对土壤微生物多样性及其功能的影响[J]. 中国环境科学, 2016, 36(12): 3793-3799 (  0) 0) |
| [10] |
郭鸿鑫, 孙崇玉, 孙立强, 等. 长期梨树种植土壤团聚体组成及有机碳分布特征[J]. 土壤, 2022, 54(2): 351-357 DOI:10.13758/j.cnki.tr.2022.02.019 (  0) 0) |
| [11] |
张宇. 氮添加对旱作麦田土壤团聚体有机碳组分及其稳定性的影响机制[D]. 北京: 中国科学院大学(中国科学院教育部水土保持与生态环境研究中心), 2023.
(  0) 0) |
| [12] |
吴林甲, 祁琛, 闫秋艳, 等. 耕作方式对旱地麦田土壤团聚体及其碳氮组分分布的影响[J]. 干旱地区农业研究, 2023, 41(2): 193-200, 220 (  0) 0) |
| [13] |
曹宏杰, 倪红伟. 大气CO2升高对土壤碳循环影响的研究进展[J]. 生态环境学报, 2013, 22(11): 1846-1852 (  0) 0) |
| [14] |
裴亚楠, 吕卫光, 郭涛, 等. 秸秆还田配施促腐菌剂对土壤团聚体及其养分的影响[J]. 应用生态学报, 2023, 34(12): 3357-3363 (  0) 0) |
| [15] |
李继文, 柳开楼, 余喜初, 等. 稻草覆盖和香根草篱联合调控红壤坡耕地土壤团聚体粒组碳钾分配规律[J]. 土壤, 2022, 54(4): 787-792 DOI:10.13758/j.cnki.tr.2022.04.017 (  0) 0) |
| [16] |
曹子铖, 程淑兰, 方华军, 等. 温带针阔叶林土壤有机碳动态和微生物群落结构对有机氮添加的响应特征[J]. 土壤学报, 2020, 57(4): 963-974 (  0) 0) |
| [17] |
陈书涛, 桑琳, 张旭, 等. 增温及秸秆施用对冬小麦田土壤呼吸和酶活性的影响[J]. 环境科学, 2016, 37(2): 703-709 (  0) 0) |
| [18] |
Poeplau C, Kätterer T, Leblans N I W, et al. Sensitivity of soil carbon fractions and their specific stabilization mechanisms to extreme soil warming in a subarctic grassland[J]. Global Change Biology, 2017, 23(3): 1316-1327 (  0) 0) |
| [19] |
熊丽. 模拟气候变化影响下水稻根系分泌物与稻田土壤有机质分子组成的变化[D]. 南京: 南京农业大学, 2020.
(  0) 0) |
| [20] |
高梦雨. 长期施用生物炭和炭基肥对土壤有机碳及团聚体微生物特性的影响[D]. 沈阳: 沈阳农业大学, 2020.
(  0) 0) |
| [21] |
Abiven S, Menasseri S, Chenu C. The effects of organic inputs over time on soil aggregate stability–A literature analysis[J]. Soil Biology and Biochemistry, 2009, 41(1): 1-12 (  0) 0) |
| [22] |
Mao R, Zhang X H, Meng H N. Effect of Suaeda salsa on soil aggregate-associated organic carbon and nitrogen in tidal salt marshes in the Liaohe Delta, China[J]. Wetlands, 2014, 34(1): 189-195 (  0) 0) |
| [23] |
刘芙蓉, 张咏梅, 邓书林. 增温和CO2浓度加倍对川西亚高山针叶林土壤可溶性氮的影响[J]. 生态学报, 2016, 36(3): 652-660 (  0) 0) |
| [24] |
Weltzin J F, Bridgham S D, Pastor J, et al. Potential effects of warming and drying on peatland plant community composition[J]. Global Change Biology, 2003, 9(2): 141-151 (  0) 0) |
| [25] |
Frey S D, Drijber R, Smith H, et al. Microbial biomass, functional capacity, and community structure after 12 years of soil warming[J]. Soil Biology and Biochemistry, 2008, 40(11): 2904-2907 (  0) 0) |
| [26] |
Hayden H L, Mele P M, Bougoure D S, et al. Changes in the microbial community structure of bacteria, Archaea and fungi in response to elevated and warming in an Australian native grassland soil[J]. Environmental Microbiology, 2012, 14(12): 3081-3096 (  0) 0) |
| [27] |
蒋雪洋, 张前前, 沈浩杰, 等. 生物质炭对稻田土壤团聚体稳定性和微生物群落的影响[J]. 土壤学报, 2021, 58(6): 1564-1573 (  0) 0) |
| [28] |
Six J, Frey S D, Thiet R K, et al. Bacterial and fungal contributions to carbon sequestration in agroecosystems[J]. Soil Science Society of America Journal, 2006, 70(2): 555-569 (  0) 0) |
| [29] |
李景, 吴会军, 武雪萍, 等. 长期不同耕作措施对土壤团聚体特征及微生物多样性的影响[J]. 应用生态学报, 2014, 25(8): 2341-2348 (  0) 0) |
 2025, Vol. 57
2025, Vol. 57


