自20世纪90年代开始,农药使用量在全球范围内呈快速上升趋势。1991年,我国农药使用总量(商品量,下同)为76.53万t,2013年迅速增长到180.19万t,增长了135.5%,年均增长率高达7.4%。在农药使用量快速增长的同时,中国农药的施用强度也在不断增加。截至2013年,我国单位面积农药施用量是世界平均水平的2.5倍[1]。据统计,农田中施用的农药量仅有30%左右附着在农作物上,其余都扩散到土壤和大气中,导致土壤中农药残留量增加,造成严重的农田土壤农药污染[2]。有机氯类农药是一种具有难降解性、高生物累积性、半挥发性和高毒性的持久性有机污染物。尽管有机氯类农药在大多数国家已禁止使用,但其高历史残留仍是亟待解决的环境问题。有机磷类、拟除虫菊酯类农药应用广泛,且因与土壤有较强的结合能力而极易在土壤中残留。有机磷类农药在土壤的结合残留高达26% ~ 80%,而拟除虫菊酯类农药的结合残留量达36% ~ 54%。近年来,除草剂需求量增大,约占农药产量比重的1/3[3]。这些农药的大量生产、不合理施用和滥用所造成的土壤污染问题日益凸显,进而影响农产品品质和人类健康[4]。随着人们对农产品安全和品质需求的提升,土壤农药污染的治理与修复已受到广泛重视,对经济型、高效型农药污染土壤修复技术的研究已成为环境科学领域的研究热点。
目前,农药污染土壤的修复方法主要有物理法、化学法和生物法等[5-6]。尽管物理法和化学法具有周期短、修复效率高等优点,但工程量较大、费用高、易产生二次污染,且对于低残留的农药污染土壤适用性差,很难大规模应用到实际污染土壤治理中[7]。而生物修复因具有经济低耗、适用范围广、无二次污染、对环境扰动性小等优点在农药污染土壤治理中具有巨大应用潜力[8]。其中,生物强化作为一种新兴的生物修复技术在污染环境治理中具有改善环境修复能力、高效降解污染物、提高处理负荷等优势[9-10]。本文介绍生物强化技术的概念及内涵,探讨影响生物强化修复效率的环境因素,阐述生物强化技术在4大类农药(有机氯类、有机磷类、拟除虫菊酯类杀虫剂和三嗪类除草剂)污染土壤修复中的研究进展,并提出生物强化技术面临的问题和进一步研究的方向。
1 生物强化技术的概念及内涵生物强化技术是向特定环境体系中(例如土壤、活性污泥、沉积物、水体等)投加功能微生物,用来去除有机污染物的一项新型生物修复技术。该技术基于微生物可利用有机污染物作为生长所需物质,将具有特定功能的微生物投入传统生物处理系统中,从而增加功能微生物的生物量、强化有机物降解能力、提高降解速率,最终达到去除某一特定环境中难降解有机污染物的目的[11]。一般适用于污染区域内土著微生物群代谢能力不足以降解目标污染物或者土著微生物群无法降解目标污染物等情况[9-10]。针对如今农田土壤的农药污染问题,生物强化技术可通过向土壤环境中投放经过筛选的、对目标污染物具有高效降解能力的细菌、真菌或其菌群来增强土壤环境体系对污染物的代谢潜力[12]。
适合应用于生物强化技术的菌种应满足以下条件:降解效率高、扩繁速度快、易培养、对高浓度污染物具有强耐受性并可以在多种环境条件下生存[10, 13-14]。高效降解菌种主要有3种来源:土著菌种、外来菌种和基因工程菌种。土著菌种修复方法是从受污染的环境中分离得到对某种污染物具有降解能力的微生物,经富集培养后重新投放入同一地域,相比原始土著微生物,此类菌种对污染物的降解能力显著提高[15]。外来菌种修复方法是当土著菌群无法良好发挥作用时,将其他地域中的高效降解菌种引入到待修复区域并使其发挥作用[16]。基因工程菌修复方法主要是通过质粒转化、基因重组和原生质体融合3种方法构建具有特异性降解能力的功能菌种。相比普通菌种,此类菌种的污染修复能力、对污染环境的耐受能力均明显提高[17]。
现有的农药高效降解菌大都是从受农药污染的土壤、污泥或是废水中分离,再经富集培养以后获得的,分析菌种的降解性能后,将其引入待修复区域(图 1)。在降解菌实际应用时,通常以菌剂形式投加到待修复环境中。这种降解菌剂是将多种降解菌按特定比例混合制成的粒状或粉末状固体,其中还含有无机营养物可供降解菌生长与增殖[18]。在降解菌剂施用后,所含的降解菌种可以将有机污染物降解、转化、降低毒性,同时降解菌不断增殖,进而提高其降解能力[19]。这种修复方法效率高、二次污染程度小,具有广阔的应用前景。近年来,基于高效降解菌的生物强化技术已被应用于多种农药污染土壤的修复中,包括有机氯类农药、有机磷类农药、拟除虫菊酯类农药、三嗪类除草剂等。
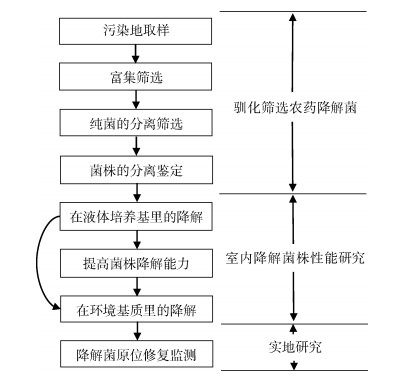
|
图 1 农药污染地生物强化降解菌筛选应用流程 Fig. 1 Screening of pesticide-degrading microorganisms for bioaugmentation of contaminated sites |
在生物强化技术实际应用于农药污染土壤修复时,多种因素可影响其修复效果。这些影响因素主要分为两类:生物因素和非生物因素,具体包括降解菌接种量[20-22]、温度[20, 23]、土壤水分[24-25]、土壤pH[20, 26-27]、土壤有机物含量[20, 28]及初始农药含量[29]等。
在生物因素方面,降解菌的接种量是最重要的影响因素之一。将外源降解菌加入到待修复土壤中后,土著菌与其竞争营养物质,导致土壤中降解菌数量下降[21]。接种量不足会降低降解菌的降解效率,而过量接种则造成菌株浪费和成本提高。因此,确定适宜的降解菌接种量是生物强化技术应用的关键。已有研究发现,当降解菌接种量小于104 cells/g土时,仅有少量降解菌在初始营养竞争中存活并在农药降解中发挥作用[29]。Singh等人[30]分离得到有机磷农药毒死蜱降解菌Enterobacter sp.,在毒死蜱初始含量为35 mg/kg土情况下,当该降解菌的接种量高于105 cells/g土时,毒死蜱降解迅速、效果明显; 当接种量低于103 cells/g土时并无降解效果。Karpouzas和Walker[20]在研究Pseudomonas putida epI降解有机磷农药灭线磷时发现,在农药初始含量为10 mg/kg土情况下,当接种量为106 cells/g土时,仅需4 d即可将灭线磷完全降解; 当接种量为105或104 cells/g土时,灭线磷的降解速率明显下降; 当接种量为103 cells/g土时,降解菌并没有发挥有效的降解作用。王光利等人[22]研究Pigmentiphaga sp. strain D-2对新型杀虫剂啶虫脒污染土壤的修复效果时发现,在农药初始含量为50 mg/kg情况下,当接种量为2×105 cfu/g或2×106 cfu/g时,啶虫脒的完全降解需要7 d时间; 但接种量为2×108 cfu/g时,仅需3 d啶虫脒的降解率就可达97.8%。综上,在考虑经济因素的基础上,目前普遍认为实现农药污染物高效降解的最佳接种量为(106~1010)cells/g土[20, 22, 30]。
在非生物因素方面,土壤pH不仅影响污染土壤中农药的稳定性,还会影响降解菌的活性和降解效率[31-32]。洪源范等人[27]在研究甲氰菊酯降解菌Sphingomonas sp. JQL4-5时发现,当初始农药含量为20 mg/kg土时,在酸性土壤中(pH 3.5 ~ 4.5)该菌株生长受到低pH抑制,其生物强化作用很弱; 在中性土壤中(pH 6.5 ~ 7.5)生物强化效果最佳,如pH为7.5时甲氰菊酯在第12天时被完全降解; 碱性环境下甲氰菊酯易分解,在pH 8.5、9.5的土壤中,由于其自身分解的影响,生物强化效果在6 d后开始下降。Li等人[33]研究了不同土壤pH条件下降解菌Sphingomonas sp. Dsp-2的生物强化效果,发现降解菌在pH 4.8和pH 8.7的土壤中对毒死蜱(初始含量100 mg/kg土)的7.0 d降解率分别为58.1%和98.7%。在另一项关于毒死蜱降解的研究中,Yang等人[34]向毒死蜱初始含量为100 mg/kg的土壤中加入毒死蜱降解菌Stenotrophomonas sp. YC-1,在pH从4.3增加到7.0的过程中毒死蜱的降解率逐渐提高; 当pH 7.0 ~ 8.4时,毒死蜱降解率并无明显变化。以上研究表明,相比低pH的酸性土壤,中性或弱碱性土壤更有利于农药降解菌发挥降解作用,这可能是因为偏酸性土壤环境会降低一些微生物(尤其是细菌)的活性[35]。
除土壤pH以外,土壤温度、含水量、有机物含量等非生物因素也会影响污染土壤的生物强化效率。在温度方面,Hong等人[21]发现有机磷农药杀螟松降解菌Burkholderia sp. FDS-1在30℃时其降解效果最佳,在20℃以及40℃时降解速率相对较低(初始农药含量为50 mg/kg土)。Karpouzas和Walker[20]对降解菌Pseudomonas putida epI降解灭线磷的研究结果表明,初始农药含量10 mg/kg土情况下,相比温度为5℃时,该降解菌在20℃或35℃时对灭线磷的降解速率显著提高。一般认为利用降解菌进行的生物强化修复最佳温度范围为25 ~ 35 ℃,这是由于在此温度范围内最适宜微生物活动,温度过高或过低微生物活性均会下降,影响降解菌发挥作用[36]。在土壤含水量方面,Singh等人[30]研究降解菌Enterobacter sp.降解毒死蜱时发现,在农药初始含量为35 mg/kg土情况下,当土壤含水量低于30%时,农药降解速率缓慢; 当土壤含水量高于40%时,农药降解效果较好,此时若增加含水量,农药降解效果无显著变化。石利利等人[25]选用含水量为50%以及150%的两种土壤,研究Plesiomonas sp. DLL-1对甲基对硫磷农药(初始含量为45 mg/kg土)的降解效果,结果发现24 h后两种土壤中甲基对硫磷的降解率均高于95%,表明高含水量有利于提高生物强化效率。在土壤有机物含量方面,Karpouzas和Walker[20]研究发现,在初始农药含量为10 mg/kg土情况下,当土壤有机物含量较低时,降解菌Pseudomonas putida epI对灭线磷的降解速率较快; 而降解速率随有机物含量增高而下降。这可能是由于低有机质土壤对有机物的吸附能力较低,有利于提高农药的生物可利用性; 反之,高有机质土壤吸附能力较强,农药的生物可利用性低,降低了降解菌对农药的生物去除效率。
在实际应用中,生物强化技术大多将农药降解菌制成降解菌剂,将其大面积喷洒于农田土壤中。此方法既无法保证降解菌在原位修复中的生物活性,也无法将菌剂在待修复区域固定,对农药的去除效率具有一定影响。侯少锋[37]研究溴氰菊酯降解菌剂原位修复效果时发现,溴氰菊酯的田间残留虽比室内试验低,但喷洒菌剂后其降解率远低于室内试验结果,推测为天气等环境因素所致。因此菌剂固定装置的设计与应用在农药污染土壤的原位修复中显得尤为重要。
此外,生物强化修复时所添加的降解菌有时仅能将农药降解成中间产物,并不能完全将其矿化,中间产物具有毒性且会抑制降解菌的生长,降低其降解效率,成为影响生物强化的另一重要因素[38]。为解决这一问题,一方面可采用连续生物强化的方法,即根据特定农药污染物的降解途径,重复多次接种降解菌; 另一方面可将高效降解菌固定于某些特定的载体材料上,以提高降解菌应对变化环境的能力,提高引入降解菌的生存能力和降解活性[39-40]。
3 生物强化技术在农药污染土壤修复中的应用 3.1 有机氯农药污染土壤的生物强化技术研究有机氯农药是一种毒性高、残留度高、对环境危害大的持久性有机污染物。虽然很多国家已经禁用此类农药,但由于其化学性质稳定、半衰期较长,这类农药在土壤中被广泛检出,对自然环境、动植物乃至人类健康具有潜在威胁,因此其修复技术备受关注。
滴滴涕(DDT)是一种被禁用多年,但在环境中仍有高残留度的有机氯农药,其化学名称为双对氯苯基三氯乙烷[41]。对DDT污染土壤的修复一直是研究热点和难点,近年来人们尝试利用生物强化修复方法来降低其环境残留。Fang等人[23]将DDT降解菌Sphingobacterium sp. strain D-6接种于污染土壤中,60 d后土壤中o, p’-DDT和p, p’-DDT含量分别为0.014和0.007 mg/kg,明显低于未接种土壤的o, p’-DDT (0.021 mg/kg土壤)和p, p’-DDT含量(0.009 mg/kg)。此外,Purnomo等人[42]研究了真菌对DDT的降解能力,发现3种褐腐真菌Gloeophyllum trabeum、Daedalae dickinsii和Fomitopsis pinicola引入经灭菌的DDT污染土壤后,DDT的降解率分别为41%、15%和9%;而在未经灭菌的另一实验组中G. trabeum、D.dickinsii和F. pinicola对于DDT的去除率分别为43%、32%和29%,这说明引入的真菌与土著降解菌可协同增强生物强化的修复效果。潘淑颖等人[43]研究表明对DDT具高耐受性的Sphingobacterium sp.和白腐真菌在不加入有机质时,21 d后对DDT的降解率均达到83%(DDT初始含量为220.3 mg/kg); 在向土壤中加入有机质后,白腐真菌降解DDT的效果更加显著并表现出较好的环境适应性,说明土壤有机质含量是影响白腐真菌对DDT降解效率的重要因素。
在基因工程菌方面,Gao等人[44]从土著DDT降解菌Sphingobacterium sp. D-6中提取调控降解效率的质粒pDOD,转化E. coli TG1,重组构建特异性降解DDT的基因工程菌E. coli TG1 (pDOD); 将E. coli TG1 (pDOD)接种于污染土壤210 d后,DDT去除率达到50.7%(初始农药含量为0.6 mg/kg),而在未接种的土壤中去除率仅为16.2%(初始农药含量为0.8 mg/kg); 同时,土壤中微生物丰度在接种基因工程菌第15天时为2×104 cfu/g土,而在第210天后增长至4×107 cfu/g土。这说明利用基因重组技术制备基因工程菌在修复DDT污染土壤中可发挥重要作用。
另一类环境残留量较高的有机氯农药是六六六(HCH)及其异构体,HCH的化学名称为六氯环己烷。我国曾大规模使用HCH作为杀虫剂,对农田土壤环境造成大面积污染。虽然我国已于1983年禁止生产HCH,但由于其高毒性、化学性质稳定、难降解等特点,目前我国部分区域农田土壤中的HCH残留量依然很高,是土壤农药污染修复的重要方面。工业生产的HCH(t-HCH)中主要包含α、β、γ、δ四种异构体,其中α-HCH占67% ~ 70%、β-HCH占5% ~ 6%、γ-HCH占13% ~ 15%、δ-HCH占6%[45]。Garg等人[46]驯化获得可降解t-HCH的菌群,该菌群的优势菌种为Sphingobium sp. UM1、Sphingobium lucknowense F2、Sphingobium chinhatense IP26、Sphingobium sp. HDIPO4和Sphingobium indicum B90A。在将该降解菌群加入受t-HCH污染的灭菌土壤(初始含量为5 mg/g)30 d后,t-HCH的去除率达到65%;而在未灭菌的土壤中接种该菌群30 d后,t-HCH的去除率达到62%。
在HCH的4种异构体中,γ-HCH是有机氯农药林丹的主要成分。与DDT和六六六相同,林丹作为毒性较高的持久性有机污染物,已被多个国家限制或禁止使用,但其环境残留问题同样非常严重[47]。Abhilash等人[48]从生长于受林丹污染土壤的植物根际分离得到Kocuria rhizophila、Microbacterium resistens、Staphylococcus equorum、Staphylococcus cohnii spp. urealyticus,这4个菌株可以用来提高土壤微生物对林丹的分解代谢能力,用林丹含量为5、50、100 mg/kg的污染土壤来模拟低、中、高程度污染,发现S. cohnii spp. urealyticus加入45 d后对林丹含量为5、50 mg/kg土壤的降解率分别达100%和70%。Boltner等人[49]研究表明Sphingomonas spp.可有效提高土壤中林丹降解率,这是由于该属细菌可以生长于植物根部并参与植物的根际修复。植物根部所释放的分泌物可促进细菌生长和代谢活性,从而提高农药污染修复效果。
除上述农药外,生物强化技术还应用于有机氯农药硫丹的污染土壤修复中。Odukkathil和Vasudevan[50]利用可产生表面活性剂的3株细菌(Bordetella petrii I GV 34、B. petrii II GV 36和Achromobacter xyloxidans GV 47)组成的菌群修复受硫丹污染的土壤(α-硫丹和β-硫丹初始含量分别为0.6 ~ 3.4 mg/g和0.3 ~ 3.1 mg/g),结果发现污染土壤中α-硫丹和β-硫丹在25 d后被完全去除。另一研究中,Arshad等人[51]发现在土壤匀浆中接种硫丹降解菌Pseudomonas aeruginosa可大大提高环境中硫丹的去除率。
3.2 有机磷农药污染土壤的生物强化技术研究由于20世纪有机氯农药的使用在多个国家地区受到限制,随着农药的不断发展,有机磷农药逐步进入市场,并成为现今使用最广泛的农药品种。
毒死蜱是使用较广泛的有机磷农药。在利用生物强化技术修复毒死蜱污染土壤方面,Yang等人[52]发现菌株Stenotrophomonas sp. YC-1可以毒死蜱作为唯一碳源和磷源,将毒死蜱水解为3, 5, 6-三氯吡啶-2-酚(TCP); 将该菌株接种于毒死蜱初始含量为100 mg/kg的土壤15 d后,毒死蜱去除率达到100%,然而在未接种降解菌的对照组土壤中降解率仅为24%。Li等人[33]研究了毒死蜱降解菌Sphingomonas sp. Dsp-2的生物修复效果,发现在毒死蜱含量为100 mg/kg的土壤中接种该降解菌7 d后毒死蜱去除率达90%,30 d后达98%。Lakshmi等人[53]筛选获得4株可降解毒死蜱的细菌(Pseudomonas fluorescens,Brucella melitensis,Bacillus subtilis和 P. aeruginosa),将他们分别接种于毒死蜱含量为50 mg/kg的土壤中,30 d后毒死蜱去除率为85% ~ 92%,而在未接种的对照组土壤中,毒死蜱30 d去除率仅为34%;在这4株降解菌中,只有P. aeruginosa可以在20 d内将部分毒死蜱分解为中间产物TCP,并且能够在30 d内将TCP完全降解。
甲基对硫磷作为另一种常用的有机磷农药,如何利用生物强化技术对其污染土壤进行修复也是目前关注的问题。Wang等人[54]研究发现相比未接种降解菌的对照组,将甲基对硫磷降解菌Pseudomonas sp. strain WBC-3接种于污染土壤后(甲基对硫磷初始含量为0.536 mg/g),甲基对硫磷仅用13 d即可完全降解,降解效率显著提高,表明利用生物强化技术接种特异性降解菌对于去除甲基对硫磷具有重要作用。赵倩等人[55]研究生物强化技术在竹林土壤中对甲基对硫磷的应用效果,土壤中甲基对硫磷初始含量为15 mg/kg,接种降解菌Plesiomonas sp. DLL-1 5 d后表层土壤中甲基对硫磷的去除率为88.6%,而10 d后去除率达到98.8%;该结果表明Plesiomonas sp. DLL-1可有效降解甲基对硫磷,但该菌株去除农药速率随时间明显减缓,这可能是由于在后期低含量农药残留时,降解菌优先利用土壤中其他有机物作为能源生长,进而导致农药去除速率降低。
针对有机磷农药杀螟硫磷,人们也对其污染土壤进行了生物强化修复效果的评估。Hong等人[21]将杀螟硫磷降解菌Burkholderia sp. FDS-1接种于受该农药污染的土壤中(农药初始含量为50 mg/kg),发现降解菌接种量对土壤中杀螟硫磷的去除效果影响较大,确定较为合适的接种量为2×106 cfu/g土,在此接种量下3 d内可将97.6%的杀螟硫磷转化为其主要代谢产物3-甲基-4-硝基苯酚(MNP),并在15 d内将MNP降解完全; 而未接种降解菌的对照组土壤在15 d内仅有30.4%的杀螟硫磷被去除,且其大部分被转化为中间产物MNP。
此外,生物强化技术在实际应用时经常出现降解菌存活率低、降解活性差等情况,为解决这一问题,人们尝试将将植物修复与微生物修复相结合,以提高降解菌的丰度和活性。例如,Yang等人[56]在修复毒死蜱污染土壤时发现,在接种毒死蜱降解菌Alcaligenes faecalis DSP3的土壤中种植甘蓝或黑麦草,可显著加快毒死蜱降解; 当在毒死蜱初始含量为50 mg/kg的污染土壤中种植甘蓝时,接种降解菌Alcaligenes faecalis DSP3,12 d后毒死蜱被完全降解,而未种植物土壤中仅有22%的毒死蜱被降解。
3.3 拟除虫菊酯类农药污染土壤的生物强化技术研究拟除虫菊酯类农药具有高度疏水性,可与土壤颗粒及有机物紧密结合,容易下渗对地下水造成污染[57]。氯氰菊酯、甲氰菊酯、溴氰菊酯、氰戊菊酯和联苯菊酯都属于拟除虫菊酯类农药,对土壤中这几种农药的生物强化去除技术研究进展做如下介绍。
Akbar等人[58]研究发现在氯氰菊酯含量为200 mg/kg的土壤中接种降解菌Acinetobacter calcoaceticus MCm5、Brevibacillus parabrevis FCm9或Sphingomonas sp. RCm6,接种量为1×107 cells/g土的情况下,在第42天土壤中氯氰菊酯总去除率为90% ~ 100%;而对于未接种降解菌的对照组土壤,第42天的去除率仅为44%。Akbar等人[59]的研究结果表明,Bacillus megaterium JCm2、O. anthropi JCm1和Rhodococcus sp. 3株细菌对土壤中氯氰菊酯也具有高效降解能力。
Chen等人[60]研究了降解菌Bacillus sp. DG-02对受甲氰菊酯污染土壤的生物强化效果,发现该降解菌可显著提高土壤中甲氰菊酯的去除率; 当土壤中甲氰菊酯初始含量为50 mg/kg时,利用生物强化技术可将甲氰菊酯在土壤中的半衰期从37.1 d缩短至5.4 d。此外,Hong等人[61]将编码甲基对硫磷水解酶的mpd基因转入甲氰菊酯降解菌Sphingobium sp. JQL4-5的染色体中,构建基因工程菌,结果表明该工程菌对甲氰菊酯与甲基对硫磷均具有降解作用。
在溴氰菊酯的生物强化应用方面,Cycoń等人[62]利用两株Serratia marcescens(DeI-1和DEI-2)去除土壤中溴氰菊酯,发现在接种两种降解菌的土壤中,农药降解率均大幅提升(溴氰菊酯初始含量为100 mg/kg); 试验结束时,接种DeI-1和DEI-2的土壤中,溴氰菊酯的去除率分别为61% ~ 82%和70% ~ 92%,而未接种降解菌的对照组中溴氰菊酯去除率为41.8% ~ 59.8%。这项研究表明Serratia marcescens在溴氰菊酯的生物强化去除中具有应用潜力。
Chen等人[63]发现利用降解菌Stenotrophomonas sp. ZS-S-01的生物强化技术是去除土壤中氰戊菊酯及其水解产物3-苯氧基苯甲酸的有效方法,其试验结果表明,向污染土壤(初始含量为50 mg/kg)中接种该降解菌9 d后氰戊菊酯的去除率为93.4%,未接种的对照组中降解率仅为28.7%;同时,接种降解菌的土壤中氰戊菊酯的水解产物3-苯氧基苯甲酸在10 d内去除率达81.4%,而对照组中只有9.7%。
在生物强化应用中大都使用细菌作为降解菌,实际上,真菌对去除环境中农药残留也具有一定的作用。研究表明,真菌对农药的去除能力主要来源于其木质素降解酶,因此真菌可以对众多农药或毒剂产生非常有效的降解作用[64]。Chen等人[65]对真菌Candida pelliculosa ZS-02生物强化修复联苯菊酯污染土壤的研究结果表明,在初始污染物含量为50 mg/kg的土壤中,接种该真菌10 d后联苯菊酯的去除率达75%;而未接种该真菌的对照组土壤中,联苯菊酯的降解率仅为8.4%,这充分说明某些真菌在生物强化去除农药中可发挥重要作用。
3.4 三嗪类除草剂污染土壤的生物强化技术研究目前已有多项利用生物强化技术去除土壤中三嗪类除草剂的研究。Morgante等人[66]研究三嗪类除草剂西玛津降解菌Pseudomonas sp. strain MHP41的生物强化效果,结果表明,在未被污染的土壤中,加入10 mg/kg西玛津并接种降解菌,28 d后西玛津去除率达89%;而未接种降解菌的对照组土壤中西玛津去除率仅为55%。对于长期污染土壤,降解菌的接种使土壤中所含西玛津的去除速率显著增加,同时改变了土壤中原有微生物的群落结构。Wan等人[67]研究利用生物强化技术将西玛津降解菌Arthrobacter sp. SD1加入西玛津初始含量为100 mg/kg的土壤后发现,降解菌SD1的加入显著提高了6 d内土壤中西玛津的去除率,但这种生物强化去除效率受土壤营养水平的影响,如过高的无机氮水平会抑制降解菌对西玛津的降解效果。Guo等人[68]利用Arthrobacter sp. SD1研究尿素对生物强化去除西玛津的影响时发现,低含量尿素(200 mg/kg)可提高西玛津的降解率,但当尿素含量高达1 000 mg/kg时会抑制生物强化进程。
针对除草剂阿特拉津污染土壤的生物修复技术研究表明,生物强化技术与生物刺激技术相结合可以更好去除土壤中农药污染残留。生物刺激是指向微生物生存环境中添加适合剂量的营养物质,以为微生物创造良好环境条件,提高微生物的代谢能力,最终加快微生物对目标污染物的去除速率[69]。Lima等人[70]的研究表明,当土壤中添加的阿特拉津含量为其推荐施用剂量的200倍时,单独利用生物强化技术可在8 d内去除污染土壤中79%的阿特拉津; 而将生物强化与生物刺激技术结合,向土壤环境中额外添加4.8 mg/kg的柠檬酸盐时,阿特拉津去除率提高到87%。这说明生物强化与生物刺激相结合可有效提高修复效率。Wang等人[71]研究发现降解菌Arthrobacter sp. strain DAT1可高效去除农田土壤中阿特拉津残留,向初始污染含量400 mg/kg的土壤中接种该降解菌3 d后阿特拉津去除率达90%。此外,Wang等人[71]还利用末端限制性片段长度多态性分析技术(TRFLP)监测阿特拉津污染土壤中接种菌的活性及代谢潜能,同时利用荧光定量PCR技术监测降解基因trzN、atzB和atzC的表达,结果表明降解基因丰度及降解菌Arthrobacter sp. strain DAT1的相对丰度随生物强化的处理时间延长呈连续增长趋势。
除上述两种三嗪类除草剂外,Silva等人[72]已将细菌Arthrobacter aurescens TC1成功应用于除草剂特丁津污染土壤的修复中,结果表明,将Arthrobacter aurescens TC1接种于特丁津含量为3.8 mg/kg的土壤后,污染土壤中的特丁津可在3 d内快速降解,其去除率达95%;而未接种降解菌的土壤中特丁津在第14天的残留量仍高达70%。
4 结语随着农业需求的快速增长,农药施用量大大增加,我国农田土壤受农药污染也随之日益加重,如不及时治理修复,残留于土壤中的农药会随土壤下渗水进入地下水,造成更为严重的水体污染,对生态系统和人类健康造成潜在危害。治理土壤农药污染在进行源头控制、低毒性替代品研发以及常规物理化学法修复时,应充分发挥生物强化技术在污染土壤修复中的优势,使生物强化技术与其他修复方法有效结合,提高生物强化对农药污染的去除效率,改善土壤环境质量。综合现有研究成果和不足,未来对生物强化修复技术的研究可在以下方面展开:①提高降解菌对农药的降解能力,驯化分离或利用基因工程构建广谱性降解菌,使其在多种农药污染的土壤环境中发挥修复作用。②目前降解菌向土壤中的投加方法多为直接喷洒法,此方法存在很多弊端,既不能准确控制降解菌投加位置也无法保证降解菌在土壤环境中的代谢活性。为解决这一技术弊端,可通过设计研究菌剂固定装置,将降解菌有效固定于待修复区域,提高其环境适应能力。③将生物强化技术与其他修复方法相结合以提高修复效率。例如,向土壤中添加适合的营养物质或采用植物-微生物联合修复方法,为微生物提供稳定的生存条件,加强土著降解菌与外来降解菌种的代谢能力,激发微生物对农药的降解潜能,提高其对重污染区域的修复能力。④重点研究生物强化原位修复土壤污染的实际应用方法,促使其大范围推广使用,并使其市场化、商品化等。
| [1] |
陈晓明, 王程龙, 薄瑞, 等. 中国农药使用现状及对策建议[J]. 农药科学与管理, 2016, 37(2): 4-8 DOI:10.3969/j.issn.1002-5480.2016.02.002 (  0) 0) |
| [2] |
仲维科, 郝戬, 孙梅心, 等. 我国食品的农药污染问题[J]. 农药, 2000, 1(7): 1-4 DOI:10.3969/j.issn.1006-0413.2000.07.001 (  0) 0) |
| [3] |
苏少泉. 加入WTO后我国农业与除草剂发展[J]. 现代化农业, 2003, 291(10): 4-6 DOI:10.3969/j.issn.1001-0254.2003.10.004 (  0) 0) |
| [4] |
谢慧, 朱鲁生, 谭梅英. 哌虫啶在土壤中的降解动态及对土壤微生物的影响[J]. 土壤学报, 2016, 53(1): 232-240 (  0) 0) |
| [5] |
李顺鹏, 蒋建东. 农药污染土壤的微生物修复研究进展[J]. 土壤, 2004, 36(6): 577-583 DOI:10.3321/j.issn:0253-9829.2004.06.001 (  0) 0) |
| [6] |
李亚平, 胡艳芳, 杨凡昌, 等. 拟除虫菊酯类农药光降解的研究进展[J]. 土壤, 2015, 47(1): 14-19 (  0) 0) |
| [7] |
赵玲, 滕应, 骆永明. 中国农田土壤农药污染现状和防控对策[J]. 土壤, 2017, 49(3): 417-427 (  0) 0) |
| [8] |
倪妮, 宋洋, 王芳, 等. 多环芳烃污染土壤生物联合强化修复研究进展[J]. 土壤学报, 2016, 53(3): 561-571 (  0) 0) |
| [9] |
吕华. 生物强化技术在环境修复中的应用进展[J]. 北方环境, 2011, 23(6): 48-49 (  0) 0) |
| [10] |
Mrozik A, Piotrowska-Seget Z. Bioaugmentation as a strategy for cleaning up of soils contaminated with aromatic compounds[J]. Microbiological Research, 2010, 165(5): 363-375 DOI:10.1016/j.micres.2009.08.001 (  0) 0) |
| [11] |
徐军祥, 杨翔华, 姚秀清, 等. 生物强化技术处理难降解有机污染物的研究进展[J]. 化工环保, 2007, 27(2): 129-134 DOI:10.3969/j.issn.1006-1878.2007.02.008 (  0) 0) |
| [12] |
Tuomela M, Vikman M, Hatakka A, et al. Biodegradation of lignin in a compost environment: A review[J]. Bioresource Technology, 2000, 72(2): 169-183 DOI:10.1016/S0960-8524(99)00104-2 (  0) 0) |
| [13] |
Singer A C, Gast C J V D, Thompson I P. Perspectives and vision for strain selection in bioaugmentation[J]. Trends in Biotechnology, 2005, 23(2): 74-77 DOI:10.1016/j.tibtech.2004.12.012 (  0) 0) |
| [14] |
Thompson I P, Gast C J V D, Ciric L, et al. Bioaugmentation for bioremediation: the challenge of strain selection[J]. Environmental Microbiology, 2005, 7(7): 909-915 DOI:10.1111/j.1462-2920.2005.00804.x (  0) 0) |
| [15] |
孙炜, 熊振湖, 刘春, 等. 生物强化及在环境污染物生物治理中的新进展[J]. 天津城市建设学院学报, 2006, 12(1): 50-54 DOI:10.3969/j.issn.1006-6853.2006.01.013 (  0) 0) |
| [16] |
Semrany S, Favier L, Djelal H, et al. Bioaugmentation: Possible solution in the treatment of bio-refractory organic compounds (Bio-ROCs)[J]. Biochemical Engineering Journal, 2012, 69(51): 75-86 (  0) 0) |
| [17] |
王悦.基因工程菌生物强化性能及土著降解菌特性研究[D].石家庄: 河北科技大学, 2013 http://cdmd.cnki.com.cn/Article/CDMD-10082-1013291227.htm
(  0) 0) |
| [18] |
文娅, 赵国柱, 周传斌, 等. 生态工程领域微生物菌剂研究进展[J]. 生态学报, 2011, 31(20): 6287-6294 (  0) 0) |
| [19] |
滕应, 骆永明, 李振高. 污染土壤的微生物修复原理与技术进展[J]. 土壤, 2007, 39(4): 497-502 DOI:10.3321/j.issn:0253-9829.2007.04.001 (  0) 0) |
| [20] |
Karpouzas D G, Walker A. Factors influencing the ability of Pseudomonas putida epI to degrade ethoprophos in soil[J]. Soil Biology & Biochemistry, 2000, 32(11/12): 1753-1762 (  0) 0) |
| [21] |
Hong Q, Zhang Z, Hong Y, et al. A microcosm study on bioremediation of fenitrothion-contaminated soil using Burkholderia sp. FDS-1[J]. International Biodeterioration & Biodegradation, 2007, 59(1): 55-61 (  0) 0) |
| [22] |
王光利, 张辉, 熊明华, 等. 降解菌Pigmentiphaga sp. strain D-2对啶虫脒污染土壤的生物修复作用[J]. 环境工程学报, 2014, 8(2): 775-781 (  0) 0) |
| [23] |
Fang H, Dong B, Yan H, et al. Characterization of a bacterial strain capable of degrading DDT congeners and its use in bioremediation of contaminated soil[J]. Journal of Hazardous Materials, 2010, 184(1/2/3): 281-289 (  0) 0) |
| [24] |
Schroll R, Becher H H, D rfler U, et al. Quantifying the effect of soil moisture on the aerobic microbial mineralization of selected pesticides in different soils[J]. Environmental Science & Technology, 2006, 40(10): 3305-3312 (  0) 0) |
| [25] |
石利利, 林玉锁, 徐亦钢, 等. DLL-1菌在土壤中对甲基对硫磷农药的降解性能与影响因素研究[J]. 环境科学学报, 2001, 21(5): 597-600 DOI:10.3321/j.issn:0253-2468.2001.05.018 (  0) 0) |
| [26] |
Grundmann S, Fuss R, Schmid M, et al. Application of microbial hot spots enhances pesticide degradation in soils[J]. Chemosphere, 2007, 68(3): 511-517 DOI:10.1016/j.chemosphere.2006.12.065 (  0) 0) |
| [27] |
洪源范, 洪青, 沈雨佳, 等. 甲氰菊酯降解菌Sphingomonas sp. JQL4-5对污染土壤的生物修复[J]. 环境科学, 2007, 28(5): 1121-1125 DOI:10.3321/j.issn:0250-3301.2007.05.033 (  0) 0) |
| [28] |
Cycoń M, Żmijowska A, Wójcik M, et al. Biodegradation and bioremediation potential of diazinon-degrading Serratia marcescens to remove other organophosphorus pesticides from soils[J]. Journal of Environmental Management, 2013, 117: 7-16 (  0) 0) |
| [29] |
Ramadan M A, Eltayeb O M, Alexander M. Inoculum size as a factor limiting success of inoculation for biodegradation[J]. Applied and Environmental Microbiology, 1990, 56(5): 1392-1396 (  0) 0) |
| [30] |
Singh B K, Walker A, Wright D J. Bioremedial potential of fenamiphos and chlorpyrifos degrading isolates: Influence of different environmental conditions[J]. Soil Biology & Biochemistry, 2006, 38(9): 2682-2693 (  0) 0) |
| [31] |
Drufovka K, Danevčič T, Trebše P, et al. Microorganisms trigger chemical degradation of diazinon[J]. International Biodeterioration & Biodegradation, 2008, 62(3): 293-296 (  0) 0) |
| [32] |
Cycoń M, Wójcik M, Piotrowskaseget Z. Biodegradation of the organophosphorus insecticide diazinon by Serratia sp. and Pseudomonas sp. and their use in bioremediation of contaminated soil[J]. Chemosphere, 2009, 76(4): 494-501 DOI:10.1016/j.chemosphere.2009.03.023 (  0) 0) |
| [33] |
Li X H, He J A, Li S P. Isolation of a chlorpyrifos- degrading bacterium, Sphingomonas sp. strain Dsp-2, and cloning of the mpd gene[J]. Research in Microbiology, 2007, 158(2): 143-149 DOI:10.1016/j.resmic.2006.11.007 (  0) 0) |
| [34] |
Yang C, Liu N, Guo X, et al. Cloning of mpd gene from a chlorpyrifos-degrading bacterium and use of this strain in bioremediation of contaminated soil[J]. FEMS Microbiology Letters, 2006, 265(1): 118-125 DOI:10.1111/j.1574-6968.2006.00478.x (  0) 0) |
| [35] |
Singh B K, Walker A, Morgan J A, et al. Effects of soil pH on the biodegradation of chlorpyrifos and isolation of a chlorpyrifos-degrading bacterium FEMS microbiology letters[J]. Applied and Environmental Microbiology, 2003, 69(9): 5198-206 DOI:10.1128/AEM.69.9.5198-5206.2003 (  0) 0) |
| [36] |
李晓亮, 秦智伟, 候利园, 等. 土壤环境因素对残留农药降解的影响[J]. 东北农业大学学报, 2009, 40(4): 132-135 DOI:10.3969/j.issn.1005-9369.2009.04.030 (  0) 0) |
| [37] |
侯少锋.溴氰菊酯降解菌剂的制备与应用[D].贵阳: 贵州大学, 2016
(  0) 0) |
| [38] |
Megharaj M, Ramakrishnan B, Venkateswarlu K, et al. Bioremediation approaches for organic pollutants: A critical perspective[J]. Environment International, 2011, 37(8): 1362-1375 DOI:10.1016/j.envint.2011.06.003 (  0) 0) |
| [39] |
Colla T S, Chen J W, Enggiap G, et al. Bioremediation assessment of diesel-biodiesel-contaminated soil using an alternative bioaugmentation strategy[J]. Environmental Science and Pollution Research, 2014, 21(4): 2592-2602 DOI:10.1007/s11356-013-2139-2 (  0) 0) |
| [40] |
Saez J M, Benimeli C S, Amoroso M J. Lindane removal by pure and mixed cultures of immobilized actinobacteria[J]. Chemosphere, 2012, 89(8): 982-987 DOI:10.1016/j.chemosphere.2012.06.057 (  0) 0) |
| [41] |
潘淑颖.土壤中有机氯农药DDT原位降解研究[D].济南: 山东大学, 2009 http://cdmd.cnki.com.cn/article/cdmd-10422-2009248529.htm
(  0) 0) |
| [42] |
Purnomo A S, Mori T, Takagi K, et al. Bioremediation of DDT contaminated soil using brown-rot fungi[J]. International Biodeterioration & Biodegradation, 2011, 65(5): 691-695 (  0) 0) |
| [43] |
潘淑颖, 马光辉, 常勇, 等. 土壤中DDT的微生物修复研究[J]. 安徽农业科学, 2013, 41(3): 1058-1060 DOI:10.3969/j.issn.0517-6611.2013.03.046 (  0) 0) |
| [44] |
Gao C M, Jin X, Ren J, et al. Bioaugmentation of DDT- contaminated soil by dissemination of the catabolic plasmid pDOD[J]. Journal of Environmental Sciences, 2015, 27: 42-50 DOI:10.1016/j.jes.2014.05.045 (  0) 0) |
| [45] |
Kumari R, Subudhi S, Suar M, et al. Cloning and characterization of lin genes responsible for the degradation of hexachlorocyclohexane isomers by Sphingomonas paucimobilis strain B90[J]. Applied and Environmental Microbiology, 2002, 68(12): 6021-6028 DOI:10.1128/AEM.68.12.6021-6028.2002 (  0) 0) |
| [46] |
Garg N, Lata P, Jit S, et al. Laboratory and field scale bioremediation of hexachlorocyclohexane (HCH) contaminated soils by means of bioaugmentation and biostimulation[J]. Biodegradation, 2016, 27(2/3): 179-193 (  0) 0) |
| [47] |
Salam J A. Remediation of lindane from environment - An overview[J]. Springer Berlin Heidelberg, 2012, 55 (  0) 0) |
| [48] |
Abhilash P C, Srivastava S, Singh N. Comparative bioremediation potential of four rhizospheric microbial species against lindane[J]. Chemosphere, 2011, 82(1): 56-63 DOI:10.1016/j.chemosphere.2010.10.009 (  0) 0) |
| [49] |
Boltner D, Patricia G, Jesus M, et al. Rhizoremediation of lindane by root-colonizing Sphingomonas[J]. Microbial Biotechnology, 2008, 1(1): 87-93 (  0) 0) |
| [50] |
Odukkathil G, Vasudevan N. Residues of endosulfan in surface and subsurface agricultural soil and its bioremediation[J]. Journal of Environmental Management, 2016, 165: 72-80 (  0) 0) |
| [51] |
Arshad M, Hussain S, Saleem M. Optimization of environmental parameters for biodegradation of alpha and beta endosulfan in soil slurry by Pseudomonas aeruginosa[J]. Journal of Applied Microbiology, 2008, 104(2): 364-370 (  0) 0) |
| [52] |
Yang C, Liu N, Guo X, et al. Cloning of mpd gene from a chlorpyrifos-degrading bacterium and use of this strain in bioremediation of contaminated soil[J]. FEMS Microbiology Letters, 2006, 265(1): 118-125 DOI:10.1111/j.1574-6968.2006.00478.x (  0) 0) |
| [53] |
Lakshmi C V, Kumar M, Khanna S. Biotransformation of chlorpyrifos and bioremediation of contaminated soil[J]. International Biodeterioration & Biodegradation, 2008, 62(2): 204-209 (  0) 0) |
| [54] |
Wang L, Chi X Q, Zhang J J, et al. Bioaugmentation of a methyl parathion contaminated soil with Pseudomonas sp. strain WBC-3[J]. International Biodeterioration & Biodegradation, 2014, 87(1): 116-121 (  0) 0) |
| [55] |
赵倩, 陈双林, 叶雪均, 等. 竹林土壤中甲基对硫磷降解菌的降解效果及其与土壤物理特性的关系[J]. 环境工程学报, 2009, 3(7): 1325-1328 (  0) 0) |
| [56] |
Yang L, Zhao Y, Zhang B, et al. Isolation and characterization of a chlorpyrifos and 3, 5, 6-trichloro-2- pyridinol degrading bacterium[J]. FEMS Microbiology Letters, 2005, 251(1): 67-73 DOI:10.1016/j.femsle.2005.07.031 (  0) 0) |
| [57] |
Oudou H C, Hansen H C B. Sorption of lambda-cyhalothrin, cypermethrin, deltamethrin and fenvalerate to quartz, corundum, kaolinite and montmorillonite[J]. Chemosphere, 2002, 49(10): 1285-1294 DOI:10.1016/S0045-6535(02)00507-6 (  0) 0) |
| [58] |
Akbar S, Sultan S, Kertesz M. Determination of cypermethrin degradation potential of soil bacteria along with plant growth-promoting characteristics[J]. Current Microbiology, 2015, 70(1): 75-84 DOI:10.1007/s00284-014-0684-7 (  0) 0) |
| [59] |
Akbar S, Sultan S, Kertesz M. Bacterial community analysis of cypermethrin enrichment cultures and bioremediation of cypermethrin contaminated soils[J]. Journal of Basic Microbiology, 2015, 55(7): 819-829 DOI:10.1002/jobm.201400805 (  0) 0) |
| [60] |
Chen S H, Zhang C, Deng Y, et al. Fenpropathrin biodegradation pathway in Bacillus sp. DG-02 and its potential for bioremediation of pyrethroid-contaminated soils[J]. Journal of Agricultural and Food Chemistry, 2014, 62(10): 2147-2157 DOI:10.1021/jf404908j (  0) 0) |
| [61] |
Hong Y F, Zhou J, Hong Q, et al. Characterization of a fenpropathrin-degrading strain and construction of a genetically engineered microorganism for simultaneous degradation of methyl parathion and fenpropathrin[J]. Journal of Environmental Management, 2010, 91(11): 2295-2300 DOI:10.1016/j.jenvman.2010.06.010 (  0) 0) |
| [62] |
Cycoń M, Żmijowska A, Piotrowska-Seget Z. Enhancement of deltamethrin degradation by soil bioaugmentation with two different strains of Serratia marcescens[J]. International Journal of Environmental Science and Technology, 2014, 11(5): 1305-1316 DOI:10.1007/s13762-013-0322-0 (  0) 0) |
| [63] |
Chen S H, Yang L, Hu M, et al. Biodegradation of fenvalerate and 3-phenoxybenzoic acid by a novel Stenotrophomonas sp. strain ZS-S-01 and its use in bioremediation of contaminated soils[J]. Applied Microbiology and Biotechnology, 2011, 90(2): 755-767 DOI:10.1007/s00253-010-3035-z (  0) 0) |
| [64] |
Rhodes C J. Applications of bioremediation and phytoremediation[J]. Science Progress, 2013, 96(4): 417-427 DOI:10.3184/003685013X13818570960538 (  0) 0) |
| [65] |
Chen S H, Luo J, Hu M, et al. Microbial detoxification of bifenthrin by a novel yeast and its potential for contaminated soils treatment[J]. PLoS One, 2012, 7(2): e30862 DOI:10.1371/journal.pone.0030862 (  0) 0) |
| [66] |
Morgante V, Lopezlopez A, Flores C, et al. Bioaugmentation with Pseudomonas sp. strain MHP41 promotes simazine attenuation and bacterial community changes in agricultural soils[J]. FEMS Microbiology Ecology, 2010, 71(1): 114-126 (  0) 0) |
| [67] |
Wan R, Yang Y, Sun W, et al. Simazine biodegradation and community structures of ammonia-oxidizing microorganisms in bioaugmented soil: Impact of ammonia and nitrate nitrogen sources[J]. Environmental Science and Pollution Research, 2014, 21(4): 3175-3181 DOI:10.1007/s11356-013-2268-7 (  0) 0) |
| [68] |
Guo Q W, Wan R, Xie S G. Simazine degradation in bioaugmented soil: Urea impact and response of ammonia-oxidizing bacteria and other soil bacterial communities[J]. Environmental Science and Pollution Research, 2014, 21(1): 337-343 DOI:10.1007/s11356-013-1914-4 (  0) 0) |
| [69] |
Morillo E, Villaverde J. Advanced technologies for the remediation of pesticide-contaminated soils[J]. Science of the Total Environment, 2017, 586: 576-597 DOI:10.1016/j.scitotenv.2017.02.020 (  0) 0) |
| [70] |
Lima D, Viana P, Andre S, et al. Evaluating a bioremediation tool for atrazine contaminated soils in open soil microcosms: The effectiveness of bioaugmentation and biostimulation approaches[J]. Chemosphere, 2009, 74(2): 187-192 DOI:10.1016/j.chemosphere.2008.09.083 (  0) 0) |
| [71] |
Wang Q F, Xie S G, Hu R. Bioaugmentation with Arthrobacter sp. strain DAT1 for remediation of heavily atrazine-contaminated soil[J]. International Biodeterioration & Biodegradation, 2013, 77: 63-67 (  0) 0) |
| [72] |
Silva V P, Matilde M S, Carla M, et al. Evaluation of Arthrobacter aurescens strain TC1 as bioaugmentation bacterium in soils contaminated with the herbicidal substance terbuthylazine[J]. PLoS One, 2015, 10(12): e0144978 DOI:10.1371/journal.pone.0144978 (  0) 0) |
 2019, Vol. 51
2019, Vol. 51


