2. 南京师范大学环境学院,南京 210023;
3. 生态环境部南京环境科学研究所,国家环境保护生物安全重点实验室,南京 210042
近年来,含Cu矿产的开采、冶炼厂三废的排放,含Cu杀菌剂的长期大量使用和城市污泥的堆肥利用,使土壤含Cu量达到原始土壤的几倍甚至几十倍[1]。我国农田土壤Cu污染现象日益严重,已威胁到环境生态的稳定及人类的安全,甚至对植物、动物及土壤微生物产生危害,引起了国内外很多科研人员的关注。Cu是水稻生长发育所必需的营养元素。但当土壤中Cu含量超过一定量时,将对水稻生长发育及产量产生影响[2]。赵江宁等[3]的研究表明,水稻成熟期土壤可交换态Cu含量与Cu胁迫下水稻抽穗和成熟期推迟的天数以及茎蘖发生、单位面积穗数、每穗颖花数和产量的下降幅度均呈显著或极显著正相关。因此,提高水稻的耐Cu性是应对农田土壤Cu污染的重要育种方向。土壤微生物活性和群落结构的变化能敏感地反映土壤质量和健康状况,是土壤环境质量评价不可缺少的重要生物学指标[4]。当Cu含量超过一定量时,微生物的生长代谢将会受到抑制,土壤微生物数量和群落结构发生改变。Wang等[5]利用DGGE图谱分析发现,土壤中重金属Cu不同提取态的含量与微生物多样性Shannon指数呈负相关,且由于生物可利用的重金属含量超过土壤微生物的忍耐极限而导致微生物基因突变及种群更新。Liu等[6]采用PLFAs分析发现,高含量的Cu胁迫下,土壤总细菌数量、微生物生物量碳及酶活性显著降低。Cu胁迫下,李月灵等[7]发现接种土壤微生物可以减轻Cu胁迫对植株造成的伤害,提高植株耐受Cu胁迫的能力。目前应用较多的分子生物学技术为PCR-DGGE技术、RFLP分析及定量PCR分析等[8],这些手段往往通量低、信息量小,本研究采用Illumina Hiseq测序技术,可以更加全面准确地分析Cu胁迫下水稻根际土壤微生物群落结构。
在环境恶化及水稻可种植面积缩小等农业问题的挑战下,转基因技术成为增产增收的重要手段和途径[9]。转基因水稻具有较强的抗逆性,崔荣荣等[10]研究发现,无论在适宜季节或非适宜季节,转基因水稻的生存竞争能力和繁育能力高于亲本。转基因技术带来经济利益的同时,其环境安全评价备受关注。土壤生态研究是转基因作物环境安全评价中的重要内容,目前证明转基因作物对生物多样性的潜在影响与非转基因作物存在本质不同的科学依据较少[11]。吴立成等[12]研究表明抗虫转基因水稻对根际土壤微生物的影响较小,且不持续。相比于外源基因的插入,生长环境的变化更易引起转基因水稻性状的改变[13]。然而,Cu胁迫是否会影响抗虫转基因水稻根际土壤微生物群落尚不清楚。根据我国土壤环境质量标准(GB15618—2008),一级、二级、三级农田土壤的Cu含量标准分别为35、100、400 mg/kg,且目前Cu污染稻田土壤Cu含量可高达101.2 mg/kg[14]。由此,本研究以抗虫转基因水稻华恢1号及其亲本水稻明恢63为研究材料,施加Cu含量100 mg/kg的Cu胁迫,测定不同处理下水稻的农艺性状,并采用定量PCR和Illumina Hiseq高通量测序技术对水稻根际土壤细菌群落丰度和结构变化情况进行探究,以明确Cu胁迫对抗虫转基因水稻农艺性状及根际土壤微生物群落结构的影响。
1 材料与方法 1.1 供试土壤及水稻种子供试土壤为南京师范大学仙林校区(118°55′E,32°06′N)内未经人为干扰的自然土壤,去除表面植被、落叶及颗粒物后,采集0 ~ 15 cm深度土壤,室内自然风干后研磨过筛(2 mm),混匀后备用。土壤基本理化性质为:pH 7.77,全氮0.41 g/kg,总有机碳2.7 g/kg,有机质4.65 g/kg,有效磷3.53 mg/kg,铵态氮0.28 mg/kg。该土壤未检测到Cu等重金属污染。供试水稻品种为明恢63(简称MH)和华恢1号(简称HH),其中明恢63为非转基因水稻,华恢1号是将抗虫基因cryAb/cryAc转入明恢63中获得的转基因水稻。水稻种子由华中农业大学植物科学技术学院提供。
1.2 试验设置及样品采集本试验选用15 cm × 25 cm PVC塑料桶作为水稻盆栽用桶,每桶称取相当于5.0 kg干土重的风干土壤,添加自来水使得盆栽桶中淹水4 ~ 5 cm,并添加不同量Cu对土壤进行为期30 d的预处理。盆栽桶口覆膜以减少水分挥发,膜上有孔以维持通气状态。试验设置2个Cu含量胁迫处理,为Cu0和Cu100处理,Cu(II)添加形态为CuCl2·3H2O,添加量分别为0、100 mg/kg(以Cu(II)含量计),每个处理设置4个重复。
重金属预处理后,每桶施入N︰P︰K为1︰1︰1的复合肥作基肥,添加量为0.5 g/kg。将培养30 d后的HH和MH水稻幼苗分别移栽至桶中,每桶3株。水稻生长期间桶内保持4 ~ 5 cm淹水层,于移栽后12 d追施氮肥(尿素,0.05 g/kg),于移栽后30 ~ 37 d (水稻分蘖后期)进行晒田,其他管理措施与田间相同。
于移栽后112 d(水稻成熟期)对水稻植株进行破坏性采样,并测定株高、生物量、籽粒重金属含量等水稻农艺性状。水稻成熟期破坏性采样后,根据土壤在水稻根系表面抖落和粘着的程度区分根际土壤及非根际土壤[15]。采集时仔细地从土壤中移出水稻根系,剧烈、快速抖动根系以将非根际土壤抖落,直至无法抖落土壤且可看清水稻根系;用无菌刮板轻轻刮取粘着在根系上的土壤(< 2 mm),尽可能剔除植物残留碎片及根系后混匀作为一个根际土壤样品。一部分根际土立即装入2 ml的离心管中于-80 ℃保存,用于微生物分子生态学分析;一部分根际土用于土壤理化性质分析。
1.3 土壤理化指标的测定土壤无机氮采用2 mol/L KCl溶液按5︰1(V/m)的水土比浸提,在20 ℃、200 r/min条件下振荡1 h过滤,滤液用流动分析仪(Skalar San Plus, Netherlands)测定;土壤pH用蒸馏水按2.5︰1(V/m)的水土比浸提,振荡10 min,静置30 min,采用台式pH计(Mettler- Toledo)测定;土壤有效磷采用盐酸-氟化铵按10︰1(V/m)的土水比浸提,钼锑抗比色法测定;土壤全氮采用凯氏消煮法测定;土壤总有机碳采用TOC分析仪(岛津TOC-L)测定。成熟期破坏性采样前,采用微电极分析仪(Unisense Microsensor Multimeter Version 2.01)测定水稻盆栽水-土界面下3.8 cm处水稻根际土壤氧化还原电位值,测定方法参考文献[16]。
1.4 土壤及植物各器官Cu含量的测定土壤样品采用0.1 mol/L盐酸溶液按5︰1(V/m)的水土比浸提,在25 ℃、250 r/min条件下振荡1 h过滤,滤液由ICP-AES测定;植物样品采用浓硝酸-高氯酸消煮,ICP-AES测定,测定方法参考文献[17]。
1.5 土壤总DNA提取本研究采用试剂盒(FastDNA® Spin Kit for Soil, MP, Biomedicals, USA)提取土壤总DNA,按试剂盒的说明,每个土壤样品称取鲜土0.5 g。DNA溶液的质量和浓度采用NanoDrop 2000(Thermo, USA)进行测定,提取好的DNA样品稀释10倍后保存于-20 ℃。
1.6 实时荧光定量PCR分析采用基于SYBR green染料法的实时荧光定量PCR技术测定土壤细菌16S rRNA基因丰度来表征细菌群落丰度。测定机器为Biorad CFX96 Real-time PCR system(Biorad, USA),SYBR green试剂选用2 × SYBR Premix Ex Taq(Takara, Japan),采用通用引物515F(5′-GTGCCAGCMGCCGCGGTAA-3′)/907R(5′-CCGTCAATTCMTTTRAGTTT-3′)从土壤微生物DNA中扩增16S rRNA基因。qPCR反应体系为20.0 μl,包括10.0 μl的2 × SYBR Premix Ex Taq、上下游引物(20 pmol/μl)各0.3、1.0 μl样品DNA模版(9.3 ~ 23.9 ng/μl)及8.4 μl灭菌超纯水。反应程序为:94 ℃预变性,5 min;40个循环(94 ℃变性30 s;52 ℃退火30 s;72 ℃延伸30 s),每循环结束后采集荧光数据;40轮扩增后,采用溶解曲线分析扩增产物的特异性,分析程序为:温度从65 ℃上升到95 ℃,此期间每上升0.5 ℃便采集荧光数据。以含有细菌16S rRNA基因的重组质粒作为标准DNA模版,根据质粒浓度和阿伏伽德罗常数计算该基因的拷贝数,分别以10倍梯度稀释各模板制作标准曲线,其浓度范围为9.61×102 ~ 9.61×108 copies/μl。每个样品3个技术重复,扩增效率为99.6%(R2为0.992),同时设置3个无模板样品为阴性对照。
1.7 高通量测序分析以提取的基因组DNA为模板,采用V4 ~ V5区引物(515F/907R)扩增16S rRNA基因以鉴定细菌群落组成及多样性,高通量测序分析委托广东美格基因科技有限公司采用Illumina Hiseq 2500平台进行分析。利用Trimmomatic软件对Raw Reads数据进行质量过滤,得到质控后的pair-end clean reads,采用FLASH拼接Hiseq测序产生的pair-end数据,最小overlap长度设置为10 bp,拼接序列最大错配比率为0.1,过滤后得到有效的拼接片段Clean Tags[18]。利用usearch软件(http://www.drive5.com/usearch/)对所有Clean Tags进行聚类,默认以97%的一致性将序列聚类成为OTU,在门(Phylum)水平上将相对丰度小于1%细菌类群和无法分类的细菌类群合并在Others。进行Alpha-多样性、Beta多样性分析,其中Chao1指数反映样品中群落的丰富度,Shannon指数综合考虑群落中物种的丰富度和均匀度。
1.8 数据处理本研究采用SPSS 16.0(IBM, USA)进行数据分析,采用独立样本T检验分析比较同一水稻品种各处理间的显著性差异;采用双因素方差分析比较不同处理及不同品种水稻农艺性状、根际土壤理化性质、根际土壤细菌微生物群落组成及结构的差异;采用Bray-Curtis距离及多变量统计学方法主坐标分析(PCoA,Principal coordinates Analysis)比较不同样品间细菌群落结构差异。
2 结果与分析 2.1 Cu胁迫对水稻根际土壤理化性质及水稻农艺性状的影响Cu胁迫处理下水稻根际土壤理化性质发生明显改变(表 1)。与Cu0处理相比,Cu100处理下水稻根际土壤全氮、铵态氮含量显著降低,水稻根际土壤有效Cu含量显著升高,MH水稻根际土壤氧化还原电位值显著上升;但水稻根际土壤pH、总有机碳含量无显著性差异。相同Cu胁迫处理下,HH及MH水稻根际土壤pH、全氮、总有机碳、铵态氮及有效Cu含量均无显著性差异,但HH水稻根际土壤氧化还原电位显著低于MH水稻。双因素方差分析显示,水稻根际土壤全氮、铵态氮含量仅受Cu胁迫显著影响,根际土壤氧化还原电位值受水稻品种与Cu胁迫的交互影响显著。可见,Cu胁迫改变了水稻根际土壤全氮、铵态氮含量及氧化还原电位值,而种植转基因水稻仅降低了根际土壤氧化还原电位值。
|
|
表 1 不同处理水稻根际土壤理化性质 Table 1 Physicochemical properties of rice rhizosphere soils under different treatments |
各处理水稻农艺性状显著不同(图 1)。与Cu0处理相比,Cu100处理水稻株高、产量、生物量均显著性降低。在Cu0处理下,移栽7周后HH水稻株高均显著高于MH水稻,但HH与MH水稻成熟期生物量及产量无显著差异;而Cu100处理下,HH与MH水稻株高、生物量及产量均无显著差异。Cu胁迫下,两种水稻各器官重金属含量分布规律均为:根 > 茎 > 叶 > 籽粒(未检测到),无Cu胁迫处理水稻各器官中未检测到Cu。HH水稻根部Cu含量显著低于MH水稻,而叶中Cu含量显著高于MH水稻。可见,Cu胁迫显著降低了水稻株高、生物量及产量,品种对水稻生长影响较小;HH和MH水稻对Cu的吸收富集程度不同。
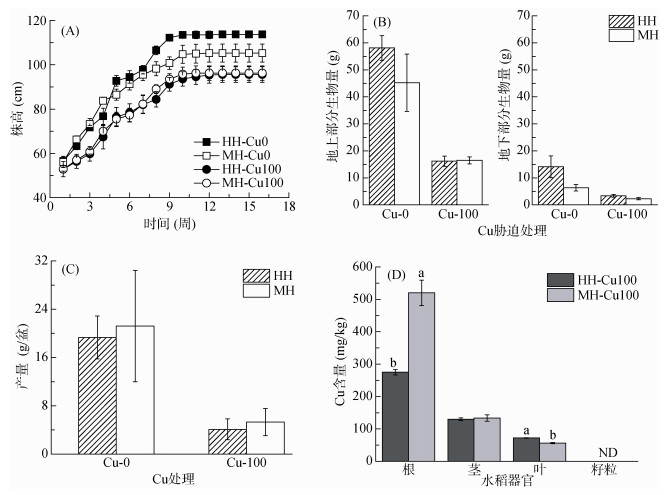
|
(图中误差线用标准误表示,n = 4;图 1D中同一簇不同字母表示Cu胁迫下两种水稻同一器官内Cu含量具有显著性差异,P < 0.05) 图 1 成熟期水稻农艺性状及各器官Cu含量 Fig. 1 Agronomic traits and Cu contents of rice at mature stage |
土壤16S rRNA基因数量可反映土壤中细菌群落丰度。HH-Cu0、MH-Cu0、HH-Cu100和MH-Cu100处理下水稻根际土壤细菌16S rRNA基因丰度分别为2.05 × 1010、1.80 × 1010、1.65 × 1010和1.95 × 1010拷贝数/g。不同含量Cu胁迫处理下,水稻根际土壤细菌群落丰度无显著差异;同一处理下,HH与MH水稻根际土壤细菌群落丰度也无显著差异。可见,Cu胁迫及水稻品种对水稻根际土壤细菌群落丰度无显著影响。
细菌群落OTU数量的稀释曲线能够反映细菌群落的多样性。Cu100处理下水稻Chao1指数及Shannon指数显著低于Cu0处理,同一处理下,两种水稻Chao1指数及Shannon指数无显著性差异(图 2)。说明无Cu胁迫水稻根际土壤细菌群落多样性、丰富度及均匀度显著高于Cu胁迫处理水稻。双因素方差分析显示,水稻根际土壤细菌群落多样性仅受Cu处理的显著影响。可见,Cu胁迫没有影响水稻根际土壤细菌丰度,但降低了细菌群落Alpha-多样性;水稻品种对土壤微生物无显著影响。
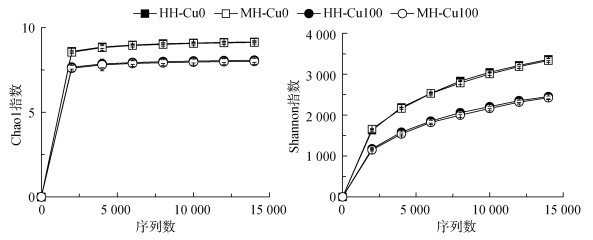
|
图 2 成熟期水稻根际土壤细菌群落丰富度和多样性指数稀释曲线 Fig. 2 Rarefaction curves of bacterial community richness and diveristy indexes in rice rhizosphere soils at mature stage |
土壤16S rRNA基因在分类水平上的相对丰度能反映土壤中细菌群落结构和组成。本研究4个处理共获取15个相对丰度高于1%的门水平上的细菌类群(图 3)。各处理中Proteobacteria(变形菌门)、Chloroflexi(绿弯菌门)、Acidobacteria(酸杆菌门)、Actinobacteria(放线菌门)、Bacteroidetes(拟杆菌门)共5个优势细菌群落,占总细菌群落的70%以上。其中Proteobacteria相对丰度最高,占总细菌群落的29.8% ~ 49.7%;Chloroflexi其次,占7.1% ~ 23.2%。与Cu0处理相比,Cu100处理下HH水稻Nitrospirae (硝化螺旋菌门)相对丰度显著下降,根际土壤Bacteroidetes相对丰度显著上升;与Cu0处理相比,Cu100处理下MH水稻根际土壤Actinobacteria相对丰度显著下降,Bacteroidetes、OP11、TM7相对丰度显著上升;同一处理下,两种水稻根际土壤门水平上的细菌类群相对丰度无显著差异。双因素方差分析显示,水稻根际土壤Actinobacteria、Bacteroidetes、Nitrospirae、OP11、TM7细菌门的相对丰度仅受Cu胁迫的显著影响。上述结果表明,Cu胁迫并没有改变水稻根际土壤中Proteobacteria、Chloroflexi、Acidobacteria等类群的相对丰度,但改变了Actinobacteria、Bacteroidetes、Nitrospirae、OP11、TM7等类群的相对丰度。可见,Cu胁迫改变了水稻根际土壤细菌群落组成,且Cu胁迫下HH与MH水稻根际细菌群落相对丰度显著改变的门类不同;相同重金属处理下,水稻品种没有影响细菌群落组成。

|
(右表显示Cu胁迫处理和水稻品种对细菌各门类群相对丰度影响的双因素方差分析结果,*和**分别代表在P < 0.05和P < 0.01水平影响显著) 图 3 成熟期水稻根际土壤细菌群落组成 Fig. 3 Bacterial community composition of rice rhizosphere soils at mature stage |
PCoA图中每个点(样品)间的空间距离表示细菌群落结构的差异程度(图 4)。其中,第1、2主坐标的方差贡献率分别为22.92%和8.25%。样品在第1、2主坐标排序中分为两类,HH-Cu0和MH-Cu0处理样品明显聚为一组,两者的Bray-Curtis相似度指数为0.12(P=0.63);HH-Cu100和MH-Cu100处理样品明显聚为一组,两者的Bray-Curtis相似度指数为0.18(P=0.87)。这两组样品点显著分开,其中HH-Cu0与HH-Cu100处理的Bray-Curtis相似度指数为1(P < 0.05),MH-Cu0与MH-Cu100处理的Bray-Curtis相似度指数为1(P < 0.05),显示Cu0与Cu100处理水稻根际土壤细菌群落结构差异显著。而同一Cu胁迫处理下,两种水稻根际土壤细菌群落结构相似。可见,Cu胁迫改变了水稻根际土壤细菌群落结构;相同重金属处理下,水稻品种没有影响根际土壤细菌群落结构。
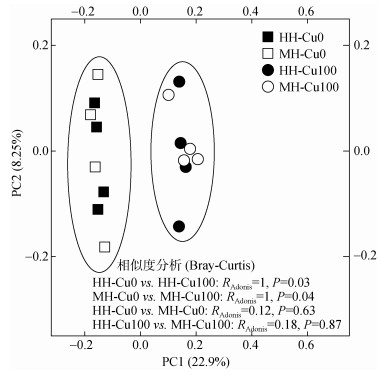
|
(RAdonis代表非参数多因素方差分析(nonparametric MANOVA)指数,由基于Bray-Curtis距离计算而来;P值指示两两处理间的显著差异) 图 4 成熟期水稻根际土壤细菌群落结构的PCoA分析 Fig. 4 Principal coordinate analysis (PCoA) of bacterial community structure in rice rhizosphere soils at mature stage |
Cu是水稻生长必需的微量元素,它在蛋白质构成、光合电子转移、线粒体呼吸和细胞壁新陈代谢等方面起着重要作用,但过量的Cu会对水稻产生毒害作用。Cu胁迫对水稻的影响主要包括以下两个方面:①Cu胁迫对水稻农艺性状的影响;②Cu胁迫对水稻根际土壤理化性质、土壤微生物群落组成、结构及多样性的影响。本研究以转基因水稻华恢1号(HH)及其亲本水稻明恢63(MH)为材料,根据我国土壤环境质量标准中规定的二级农田土壤Cu含量标准,添加100 mg/kg Cu(II)进行胁迫处理,发现Cu胁迫改变了根际土壤理化性质,降低了水稻农艺性状、根际土壤微生物多样性、群落结构及组成,但HH和MH水稻上述指标无显著差异。
3.1 Cu胁迫对水稻农艺性状的影响本研究结果显示Cu胁迫后,水稻株高、产量、生物量均显著降低,且两种水稻各器官重金属含量分布规律均为:根 > 茎 > 叶 > 籽粒(未检测到)。徐加宽等[19]研究表明,土壤Cu处理使水稻产量显著低于对照,且随着土壤Cu含量的提高水稻产量及生物量下降幅度显著增大;与本研究不同的是,Cu含量100 mg/kg处理对水稻株高几乎没有影响。Yan等[2]研究发现,Cu含量100 mg/kg处理下几种水稻的平均产量均显著降低,且水稻产量与水稻穗数和每穗花颖数呈正相关;与本研究不同的是,其检测到水稻籽粒中Cu含量显著高于对照,但未超过绿色大米Cu含量限制(10 mg/kg)[20],表明Cu含量100 mg/kg的水稻土不会通过食物链影响人类食物安全。颜士敏等[21]研究显示,施加400 mg/kg Cu胁迫对不同品种水稻产量及结实率影响差异很大。Xu等[22]研究发现,Cu含量100、300 ~ 500、1 000 mg/kg胁迫下,水稻产量分别下降10%、50%、90%,高浓度的Cu严重抑制了水稻的生长,且受Cu胁迫危害最大的水稻器官为根部;与本研究结果不同的是,其发现当Cu含量低于150 ~ 200 mg/kg时,水稻籽粒中Cu含量随土壤Cu含量上升而升高。刘光荣等[23]研究显示,Cu在水稻植株各部分的富集情况是:根 > 茎叶 > 籽粒,这与本研究结果相同。郭家文等[24]研究表明甘蔗根、茎、枯叶、梢头对Cu的积累能力总体表现为根 > 茎 > 枯叶 > 梢头。杨桂芬和李德波[25]的研究表明,高浓度Cu在水稻根部累积,会使水稻根系变粗,根毛变少,影响根系对养分的吸收,谷粒不饱满,造成减产;水稻各器官Cu累积量随土壤施Cu量的增加而增加,其分配规律为:根 > 茎叶 > 籽粒。转基因植物由于外源基因的导入,对重金属积累模式会有深远的影响[26]。本研究中Cu胁迫降低了水稻的农艺性状,两种水稻对Cu的吸收富集程度不同,其中HH水稻根部Cu含量显著低于MH水稻,造成两种水稻根部对Cu吸收富集程度差异的机制,及其是否与外源基因的转入、根际土壤微环境不同有关等相关问题有待于进一步研究。
3.2 Cu胁迫对水稻根际土壤理化性质、微生物群落组成及结构的影响本研究结果显示,Cu胁迫后MH水稻根际土壤氧化还原电位值显著上升,根际土壤理化性质发生变化,这与Ben等[27]及Song等[28]的研究结果相似,Song等[28]认为这可能与海藻糖的净化机制相关。徐家宽等[29]研究发现,随着土壤Cu含量的增加,水稻拔节期、抽穗期和成熟期吸氮量均显著下降,本研究中Cu胁迫后水稻根际土壤全氮含量显著上升,是否与水稻受Cu胁迫后吸氮量降低相关?这有待进一步对水稻植株氮素吸收利用等问题进行论证。
本研究还发现Cu胁迫没有影响水稻根际土壤细菌丰度。然而,王秀丽等[30]研究表明,冶炼厂周围农田土壤的全Cu含量随离厂区距离的增加而渐降,土壤微生物生物量则随离厂区距离的增加而增大;Ellis等[31]也报道,随着土壤中全Cu含量的提高,土壤中的可培养微生物总量显著减少,研究结果的差异可能与供试土壤、Cu胁迫浓度不同有关。本研究采用Illumina Hiseq高通量测序技术发现Cu胁迫降低了水稻根际土壤细菌多样性,相似地,Mao等[32]通过向水稻根际土壤中添加Cu(II)胁迫,土壤中产甲烷菌及甲烷氧化菌群落多样性和丰富度显著降低;Li等[33]研究发现在Cu、Zn冶炼厂周围,土壤微生物多样性随重金属浓度增加而降低;张雪晴[34]利用PCR- DGGE研究发现,随着土壤Cu污染程度的加大,细菌群落丰富度及Shannon指数降低,细菌群落多样性下降;Li等[35]利用T-RFLP技术研究Cu含量0 ~ 3 200 mg/kg胁迫下土壤微生物群落组成及多样性,其中Cu含量100 mg/kg胁迫下,土壤16S rRNA基因、氨氧化古菌和细菌群落数量显著下降;微生物群落PCoA多样性分析结果显示,同一含量Cu胁迫样品明显聚为一组,且低Cu胁迫与高Cu胁迫样品显著分开,Cu胁迫改变了土壤微生物数量及多样性。这些研究均表明,一定的Cu胁迫会降低土壤细菌群落多样性。
本研究中,Cu胁迫改变了水稻根际土壤细菌群落组成及群落结构。Choudhary等[36]研究发现,在Cu等重金属的胁迫下,由于净化机制,脯氨酸、丙二醛和超氧化物歧化酶含量上升,藻青菌(Cyanobacterium)的生长受到抑制。Wang等[5]研究发现在距离Cu冶炼厂200 m处土壤磷酸酶活性明显降低,通过PCR-DGGE分析证明重金属影响土壤细菌及放线菌的群落结构。本研究Cu胁迫下,HH水稻根际土壤细菌中Nitrospirae(硝化螺旋菌门)相对丰度显著下降,根际土壤Bacteroidetes(拟杆菌门)相对丰度显著上升;MH水稻根际土壤Actinobacteria(放线菌门)相对丰度显著下降,Bacteroidetes、OP11、TM7相对丰度显著上升。谢家辉等[37]利用DGGE技术对采集的Cu矿污染土壤样品进行微生物分子生态多样性进行研究,表明不同重金属浓度对微生物多样性的影响不是简单的线性关系,重金属污染可能改变原有微生物群落内种群间的关系,新的耐受菌种产生,而原优势种群失去优势作用。本研究中HH与MH水稻根际土壤细菌群落相对丰度显著改变的门类不同,说明两种水稻根际土壤内Cu胁迫影响的优势种群不同,新的耐受菌种也不同,而造成这种差异的原因,及其是否与水稻品种、水稻根际土壤微环境的变化有关等问题还有待进一步研究。另外,土壤微生物的演变是长期且复杂的过程,Cu胁迫对抗虫转基因水稻根际土壤微生物的影响需要长期连续种植后进行验证,且其影响机制也需要进一步探究。
4 结论相比于不施加Cu胁迫对照,Cu胁迫显著抑制了水稻株高、生物量及产量,降低了根际土壤细菌群落Alpha-多样性,改变了水稻根际土壤细菌群落组成和群落结构;相比于亲本非转基因水稻,种植抗虫转基因水稻仅影响了水稻根际土壤氧化还原电位,改变了重金属在水稻各器官的吸收富集程度。即Cu胁迫抑制了水稻农艺性状及根际土壤细菌群落,抗虫转基因水稻和亲本非转基因水稻在Cu胁迫抗性上无明显差异。本研究可为抗虫转基因水稻生态安全评价提供实验数据。
| [1] |
陈卫平, 杨阳, 谢天, 等. 中国农田土壤重金属污染防治挑战与对策[J]. 土壤学报, 2018, 55(2): 261-272 (  0) 0) |
| [2] |
陈杰, 宋靖珂, 张晶, 等. 不同钝化剂对铜污染土壤原位钝化修复[J]. 土壤, 2016, 48(4): 742-747 (  0) 0) |
| [3] |
赵江宁, 王云霞, 沈春晓, 等. 土壤铜污染对水稻产量形成的影响: 5年定位试验[J]. 农业环境保护, 2012(11): 2073-2081 (  0) 0) |
| [4] |
Maarit N R, Heiskanen I, Wallenius K, et al. Extraction and purification of DNA in rhizosphere soil samples for PCR-DGGE analysis of bacterial consortia[J]. Journal of microbiological methods, 2001, 45(3): 155-165 DOI:10.1016/S0167-7012(01)00253-6 (  0) 0) |
| [5] |
Wang Y P, Shi J Y, Wang H L, et al. The influence of soil heavy metals pollution on soil microbial biomass, enzyme activity, and community composition near a copper smelter[J]. Ecotoxicology and environmental safety, 2007, 67(1): 75-81 (  0) 0) |
| [6] |
Liu A, Cao H, Yang Y, et al. Combinational effects of sulfomethoxazole and copper on soil microbial community and function[J]. Environmental Science and Pollution Research, 2016, 23(5): 4235-4241 (  0) 0) |
| [7] |
李月灵, 金则新, 李钧敏, 等. 接种土壤微生物对铜胁迫下海州香薷生长及光合生理的影响[J]. 生态学报, 2015, 35(12): 3926-3937 (  0) 0) |
| [8] |
纪洋, 于海洋, Conrad R, 等. 间隙灌溉和控释肥施用对稻田土壤产甲烷微生物的影响[J]. 土壤, 2017, 48(6): 1132-1139 (  0) 0) |
| [9] |
汪魏, 许汀, 卢宝荣. 抗除草剂转基因植物的商品化应用及环境生物安全管理[J]. 杂草科学, 2010(4): 1-9 DOI:10.3969/j.issn.1003-935X.2010.04.001 (  0) 0) |
| [10] |
崔荣荣, 韦颖, 孟攀潘, 等. 抗草铵膦转基因水稻明恢86B杂草化潜力评价[J]. 中国水稻科学, 2012, 26(4): 467-475 DOI:10.3969/j.issn.1001-7216.2012.04.012 (  0) 0) |
| [11] |
Dale P J, Clarke B, Fontes E M. Potential for the environmental impact of transgenic crops[J]. Nature Biotechnology, 2002, 20(6): 567-574 (  0) 0) |
| [12] |
吴立成, 李啸风, 叶庆富, 等. 转cry1Ab基因水稻中毒蛋白的表达、分泌及其在土壤中的残留[J]. 环境科学, 2004, 25(5): 116-121 DOI:10.3321/j.issn:0250-3301.2004.05.026 (  0) 0) |
| [13] |
Wang Y, Xu W T, Zhao W W, et al. Comparative analysis of the proteomic and nutritional composition of transgenic rice seeds with Cry1 ab/ac genes and their non- transgenic counterparts[J]. Journal of Cereal Science, 2012, 55(2): 226-233 DOI:10.1016/j.jcs.2011.12.004 (  0) 0) |
| [14] |
Cao Z H, Hu Z Y, Wong M H. Copper contamination in paddy soils irrigated with wastewater[J]. Chemosphere, 2000, 41(1/2): 3-6 (  0) 0) |
| [15] |
刘微, 王树涛, 陈英旭, 等. 转Bt基因水稻根际土壤微生物多样性的磷脂脂肪酸(PLFAs)表征[J]. 应用生态学报, 2011, 22(3): 727-733 (  0) 0) |
| [16] |
Wang Z, Deng H, Chen L, et al. In situ measurements of dissolved oxygen, pH and redox potential of biocathode microenvironments using microelectrodes[J]. Bioresource Technology, 2013, 132(2): 387-390 (  0) 0) |
| [17] |
白如霞, 刘海, 王玉书, 等. 四川省凉山州紫茎泽兰的重金属含量及其肥用安全性评价[J]. 土壤学报, 2018, 55(2): 432-442 (  0) 0) |
| [18] |
徐白璐, 钟文辉, 黄欠如, 等. 长期施肥酸性旱地土壤硝化活性及自养硝化微生物特征[J]. 环境科学, 2017, 38(8): 3473-3482 (  0) 0) |
| [19] |
徐加宽, 杨连新, 王志强, 等. 土壤铜含量对水稻生长发育和产量形成的影响[J]. 中国水稻科学, 2005, 19(3): 262-268 DOI:10.3321/j.issn:1001-7216.2005.03.011 (  0) 0) |
| [20] |
中华人民共和国国家卫生健康委员会.食品中铜限量卫生标准: GB 15199—1994[S].北京: 中国标准出版社, 1994.
(  0) 0) |
| [21] |
颜士敏, 杨洪建, 杨连新, 等. 铜污染对不同水稻品种产量及其构成因子的影响[J]. 安徽农学通报, 2008, 14(6): 67-70 DOI:10.3969/j.issn.1007-7731.2008.06.034 (  0) 0) |
| [22] |
Xu J K, Yang L X, Wang Z Q, et al. Toxicity of copper on rice growth and accumulation of copper in rice grain in copper contaminated soil[J]. Chemosphere, 2006, 62(4): 602-607 DOI:10.1016/j.chemosphere.2005.05.050 (  0) 0) |
| [23] |
刘光荣, 魏林根, 周荣娇, 等. 水稻品种间对铜的富集和分布差异性特征初探[J]. 江西农业大学学报, 2006, 28(1): 12-15 (  0) 0) |
| [24] |
郭家文, 崔雄维, 张跃彬, 等. 重金属铜在甘蔗体内的吸收及对甘蔗产量和品质的影响[J]. 土壤, 2010, 42(4): 606-610 (  0) 0) |
| [25] |
杨桂芬, 李德波. 我国南方某些铜矿附近水稻土铜污染的调查研究[J]. 农村生态环境, 1990(4): 55-58 (  0) 0) |
| [26] |
Pavlikova D, Macek T, Mackova M, et al. The evaluation of cadmium, zinc and nickel accumulation ability of transgenic tobacco bearing different transgenes[J]. Plant, Soil and Environment - UZPI(Czech Republic), 2004, 50(12): 513-517 (  0) 0) |
| [27] |
Ben M M, Sakouhi L, Karmous I, et al. Protective role of exogenous phytohormones on redox status in pea seedlings under copper stress[J]. Journal of Plant Physiology, 2017, 221: 51-61 (  0) 0) |
| [28] |
Song Y F, Cui J, Zhang H X, et al. Proteomic analysis of copper stress responses in the roots of two rice (Oryza sativa L.) varieties differing in Cu tolerance[J]. Plant and Soil, 2013, 366(1-2): 647-658 DOI:10.1007/s11104-012-1458-2 (  0) 0) |
| [29] |
徐加宽, 杨连新, 王志强, 等. 土壤铜含量对水稻氮素吸收利用及其产量的影响[J]. 扬州大学学报(农业与生命科学版), 2008, 29(2): 72-76 (  0) 0) |
| [30] |
王秀丽, 徐建民, 谢正苗, 等. 重金属铜和锌污染对土壤环境质量生物学指标的影响[J]. 浙江大学学报(农业与生命科学版), 2002, 28(2): 190-194 DOI:10.3321/j.issn:1008-9209.2002.02.017 (  0) 0) |
| [31] |
Ellis R J, Neish B, Trett M W, et al. Comparison of microbial and meiofaunal community analyses for determining impact of heavy metal contamination. J Microbiol Methods[J]. Journal of Microbiological Methods, 2001, 45(3): 171-185 DOI:10.1016/S0167-7012(01)00245-7 (  0) 0) |
| [32] |
Mao T T, Yin R, Deng H. Effects of copper on methane emission, methanogens and methanotrophs in the rhizosphere and bulk soil of rice paddy[J]. Catena, 2015, 133: 233-240 DOI:10.1016/j.catena.2015.05.024 (  0) 0) |
| [33] |
Li Z J, Xu J M, Tang C X, et al. Application of 16 S rDNA- PCR amplification and DGGE fingerprinting for detection of shift in microbial community diversity in Cu-, Zn-, and Cd-contaminated paddy soils[J]. Chemosphere, 2006, 62(8): 1374-1380 DOI:10.1016/j.chemosphere.2005.07.050 (  0) 0) |
| [34] |
张雪晴. 铜矿重金属污染对土壤微生物群落多样性和酶活力的影响[J]. 生态环境学报, 2016, 25(3): 517-522 (  0) 0) |
| [35] |
Li J, Zheng Y M, Liu Y R, et al. Initial Copper Stress Strengthens the Resistance of Soil Microorganisms to a Subsequent Copper Stress[J]. Microbial Ecology, 2014, 67(4): 931-941 (  0) 0) |
| [36] |
Choudhary M, Jetley U K, Abash K M, et al. Effect of heavy metal stress on proline, malondialdehyde, and superoxide dismutase activity in the cyanobacterium Spirulina platensis- S5[J]. Ecotoxicology and Environmental Safety, 2007, 66(2): 204-209 (  0) 0) |
| [37] |
谢学辉, 范凤霞, 袁学武, 等. 德兴铜矿尾矿重金属污染对土壤中微生物多样性的影响[J]. 微生物学通报, 2012, 39(5): 624-637 (  0) 0) |
2. School of Environment, Nanjing Normal University, Nanjing 210023, China;
3. State Environmental Protection Key Laboratory of Biosafety, Nanjing Institute of Environmental Sciences, Ministry of Ecology and Environment of the People's Republic of China, Nanjing 210042, China
 2020, Vol. 52
2020, Vol. 52


