目前农药残留降解菌剂大多为液体剂型,其长距离运输不方便,保存期较短。固体剂型相对于液体剂型而言,其保存期长、运输及施用方便[1-3]。但目前对于农药残留降解菌的固体剂型的研究很少。微生物固体菌剂的研究大多采用载体吸附方法,应用于菌剂吸附的载体应具有对微生物无毒、抗微生物分解、易于携带运输、价格低廉等特点[4-6]。目前研究常使用的载体有土壤、珍珠岩、淤泥、泥炭、硅藻土、菌糠、米糠、秸秆、蛭石、有机堆肥、海藻酸钠、锯末、煤炭、高岭土等[7-9]。载体材料大多都具备多孔的结构,可以容纳不断进行增殖的接种微生物,从而使得载体内接种微生物的密度增大。
微生物固体菌剂的质量优劣主要体现在3个方面,一是菌剂要有良好的适应能力,微生物的活性强;二是要有较长的货架期;三是要有较高的有效活菌数和较低的杂菌污染率[10-12]。基于此,本文首先利用常见的载体泥炭、花生壳粉、米糠以及有机堆肥来吸附菌剂。菌剂中所含的多菌灵及啶虫脒降解菌株由本实验室分离并保藏,所用的多菌灵降解菌株djl-6在3 d内将100 mg/L多菌灵降解100.0%,啶虫脒降解菌株D-2在3 d内将50 mg/L啶虫脒降解99.0%[13-14]。然后以泥炭作为对照,探究有机堆肥作为吸附载体的微生物菌剂的活菌数量变化及其保存期,并通过盆钵土壤试验检测了保藏后的菌剂的降解效果。本文的研究可以为降解菌固体菌剂的应用和保存提供一些理论基础。
1 材料与方法 1.1 材料和试剂供试载体:泥炭、米糠、花生壳粉购自晟图园艺有限公司,蚯蚓粪有机肥、鸡粪有机肥、猪粪有机肥、秸秆有机肥购自南京易循环农业科技有限公司,上述各供试材料均在自然状态下风干3 d后过40目筛,经121 ℃间歇式高压湿热灭菌后备用。
多菌灵原药购自江苏新沂农药厂(纯度99.8%)。啶虫脒原药购自绿源制药(纯度98.3%)。
1.2 供试菌株与土壤多菌灵降解菌株Rhodococcus qingshengii djl-6、啶虫脒降解菌株Pigmentiphaga sp. D-2,均由本实验室分离并保藏。
供试土壤为黄棕壤,采集于南京农业大学牌楼实验基地。土壤基本理化性质:pH 6.91,全氮0.86 g/kg,有效氮15.76 mg/kg,全磷0.32 g/kg,有效磷7.95 mg/kg,全钾1.41 g/kg,有效钾80.27 mg/kg,有机质15.12 g/kg,总碳6.84 g/kg。
1.3 载体材料基本性质测定各供试载体的含水率采用烘干法[15]进行测定;pH采用pH仪测定[16];氮、磷、钾含量分别采用半微量凯式定氮法、钼锑抗试剂测定法以及氢氧化钠熔融-原子吸收分光光度计法测定[17-18];每个载体设3个重复,最终结果取3次测定的平均值。
准确称取100 g已灭菌的载体材料放于封口袋内,在无菌条件下,按照一定梯度加入无菌水到载体材料中,并用玻璃棒将载体与无菌水进行充分的搅匀混合,直至载体与无菌水混匀且载体疏松、湿润不成块。以100 g干燥的灭菌载体所能吸附的水分作为载体的吸水率,每个处理设置3个重复,取3次试验的平均值作为载体的吸水率。
1.4 载体对菌株生长的影响准确称取经灭菌后的不同载体各20 g,分别加入到盛有200 ml去离子水的三角瓶中,然后置于30 ℃摇床中150 r/min振荡24 h。振荡后取4 ml加入到已灭菌空试管中,进行高温灭菌。灭菌后再向其中每个试管中分别加入0.1 ml的菌株D-2和菌株djl-6的种子液,置于摇床中于150 r/min、30 ℃条件下继续培养,分别于2 d和4 d进行取样,利用稀释涂布平板法计数。通过与原始接种菌液中的菌数进行比较,判断载体是否对降解菌菌株的生长有抑制作用。每个处理设置3个平行。
1.5 载体的单一最大吸菌量准确称取已经灭菌的不同载体各2 g分装到50 ml干净的灭菌离心管中,将各载体分别与10 ml降解菌菌株D-2和djl-6的菌液在常温条件下吸附5 h,放置于离心机中以4 ℃、1 000 r/min离心10 min,离心后倾去上清液,继续向沉淀中加入10 ml无菌水,于涡旋仪上充分振荡5 min后,再次置于离心机中以4 ℃、1 000 r/min离心10 min,倾出上清液,测定其中的活菌数。重复3次,3次测得的总菌数除以加入的载体质量即为单位载体的单一最大吸菌量[19-20],每个处理设置3个平行。
1.6 菌剂的有效菌数释放率将载体菌剂制备后置于阴凉处室温保存2 d,然后取2 g加入到装有玻璃球的20 ml无菌水中,以150 r/min条件下振荡2 h,取出后立即采用稀释涂布,测定菌剂中释放的有效活菌数,每个处理设置3个平行。有效菌数释放率(%)=载体菌剂释放的有效菌密度/接种的细菌密度(cfu)×100
1.7 菌剂活菌数检测采用稀释涂布平板法,分别准确称取不同处理的菌剂2 g加入到盛有20 ml无菌水的三角瓶中,并在其中放置玻璃珠;静置30 min后置于摇床中,充分震荡30 min,得到的菌悬液即为10-1菌悬液。将菌悬液吸取1 ml加入到盛有9 ml无菌水的试管中继续稀释,如此重复,将稀释液稀释到合适的浓度梯度后,分别吸取0.1 ml稀释液涂布于固体LB培养基的平板上,每个处理设置3个平行,每个梯度设置3个平行,培养3 d后进行菌落计数。
1.8 菌剂含水率的变化将菌剂制备后放置于阴凉处保存,于120 d时称取不同菌剂处理各5 g,进行载体菌剂的含水率测定。含水率采用烘干法测定[15]。
1.9 土壤农药残留降解在供试土壤中分别加入多菌灵和啶虫脒的水溶液,搅拌均匀,使土壤中多菌灵和啶虫脒浓度分别为5 mg/kg干土和10 mg/kg干土。用清水调节土壤含水率为20%,静置3 h后使啶虫脒和多菌灵能够充分被土壤吸收。在无菌条件下准确称取保存30 d的各个载体菌剂20 g,与含有多菌灵和啶虫脒的180 g供试土壤进行混匀,将其分装于两层一次性塑料杯中,用黑色塑料袋遮盖防止农药的光解,向其中加入无菌水至其含水量为20%;并设置加入农药而不加降解菌的对照。置于光照培养箱中,模拟自然环境,白光照射12 h,温度为26 ℃,黑暗状态12 h,温度为20 ℃。分别于第3、5、7、10天取不同处理的土样萃取后,采用HPLC检测土壤中多菌灵和啶虫脒的残留量。
2 结果与分析 2.1 载体材料的基本性质载体的吸水能力直接影响菌株的生存,载体吸水率是一个表征菌剂质量的指标。在自然条件下风干3 d后的载体的吸水能力如表 1所示,在普通载体中以花生壳粉和米糠吸水率最高,分别达到了96.00% 和87.33%,泥炭吸水率最低,仅为63.67%;而在有机肥载体中,鸡粪肥吸水率最低,仅为58.00%,秸秆肥吸水率最高,达到了73.00%。载体作为菌剂吸附的基质,为微生物的生长提供水分。在一定范围内,载体的吸水率越高,说明载体的持水能力越强,保水能力也就越强,过多的水分也能够疏泄出去。
|
|
表 1 不同载体的吸水率、含水率、pH和营养成分 |
自然条件下风干后的载体含水率不宜过高,过高会产生霉变,过低又难以供给接种微生物的日常需求,因此载体的含水率对于菌剂来说也至关重要。不同载体的含水率如表 1所示,不同载体之间含水率差异明显,载体自然条件下风干3 d后的含水率介于7.09% ~ 16.70%。在普通载体中以泥炭处理最低,为7.09%,而含水率最高的处理为米糠,高达10.60%;在有机肥类载体中,含水率为11.10% ~ 16.70%,其中猪粪有机肥的含水率最高,为16.70%,秸秆肥最低,为11.10%。各载体自然状态下的含水率能够满足接种微生物的生长。
pH是一个影响微生物生存的重要因素,绝大多数微生物生存的pH介于6 ~ 8。而本研究所用的两株降解菌的生长及降解也随pH变化而产生影响。常规载体pH变化的幅度较小,幅度仅为0.84,常规载体均呈现出弱酸性,其中以花生壳粉最低,为5.95,泥炭最高,为6.79;而有机肥类载体方面pH幅度较大,为1.47,其中以猪粪肥最高,为8.30,蚯蚓粪肥最低,为6.83。
不同载体的营养成分见表 1,其中花生壳粉的氮、磷、钾含量最低,分别为1.70、0.60和2.60 g/kg。全氮含量最高的载体为猪粪肥,达到了13.66 g/kg,各处理差异显著。全磷含量除花生壳粉外,各载体含磷量均高于对照泥炭。全钾含量最高的为泥炭,达到9.07 g/kg。
2.2 不同载体对菌株生长的影响载体不仅能够为微生物的生长提供养分,而且对微生物的生长有一定影响,是微生物赖以生存的空间。良好的载体应当有利于微生物的生长繁殖,能够有效地提高微生物在土壤以及植物根系中的存活率。由图 1可以看出,接种菌株djl-6和D-2后,本研究所使用的载体均表现出对供试菌株djl-6、D-2的生长无害,而且能够促进供试菌株的生长,可以用作载体来制备djl-6、D-2菌剂。
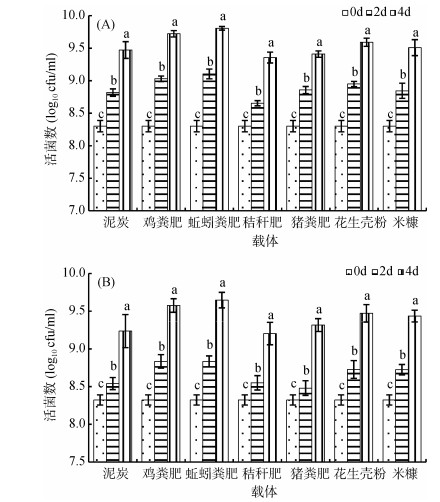
|
(djl-6;B. D-2;图中小写字母不同表示同一载体不同培养时间菌株活菌数差异达P < 0.05显著水平) 图 1 不同载体对菌株生长的影响 |
载体的单一吸菌量也是表征载体质量的一个标准,单一吸菌量指的是单位质量的载体所能吸附的最大活菌数。良好的载体需要有一个较大的吸菌量,从而能够增加细胞的密度。各项载体的单一最大吸菌量如图 2所示,其中对于菌株djl-6来说,以泥炭作为吸附载体的处理最高,能够达到2.30×1011 cfu/g;以猪粪有机肥最低,仅为2.69×1010 cfu/g。对于菌株D-2来说,也是以泥炭作为吸附载体的处理最高,能够达到1.65×1011 cfu/g;以猪粪有机肥最低,仅为2.39×1010 cfu/g。
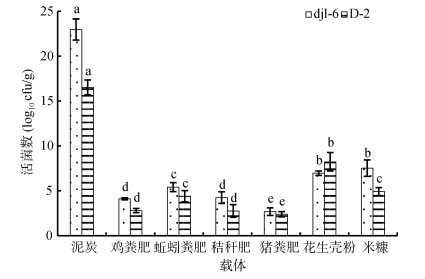
|
(图中小写字母不同表示同一菌株不同载体间单一最大吸菌量差异达P < 0.05显著水平) 图 2 不同载体的单一最大吸菌量 |
载体的有效菌数释放率也是一个表征菌剂质量的标准,在选择微生物的载体时除了要考虑到其吸附能力之外,还必须测定其能够释放的有效活菌数,即真正能够被释放出来的活菌数。以djl-6作为菌剂接种微生物的载体的有效菌数释放率如图 4所示,其中以蚯蚓粪肥为载体的有效菌数释放率最高,达到了100.40%;而以秸秆肥作为载体的有效菌释放率最低,仅为34.27%。以D-2作为菌剂接种微生物的载体的有效菌数释放率与djl-6一致,即以蚯蚓粪肥为载体的有效菌数释放率最高,达到了82.03%;以秸秆肥作为载体的有效菌数释放率最低,仅为39.65%。
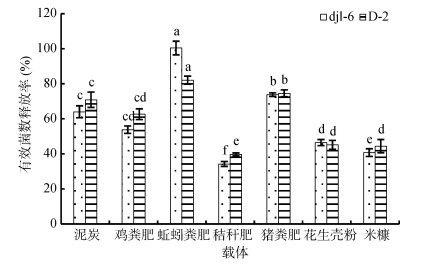
|
(图中小写字母不同表示同一菌珠不同载体间有效菌数释放率差异达P < 0.05显著水平) 图 3 不同载体的有效菌数释放率 |
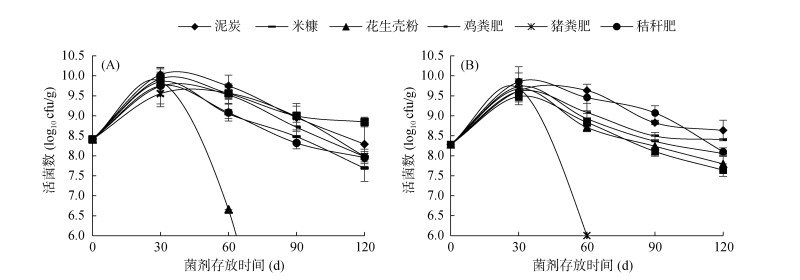
|
(djl-6;B. D-2) 图 4 不同载体菌剂活菌数变化 |
以djl-6、D-2为接种微生物的菌剂活菌数变化如图 4所示,随着保存时间的延长,其中各项载体菌剂的活菌数均呈现下降状态,以30 d时活菌数最多,因此,菌剂应在30 d内使用最为合适。以djl-6做接种微生物的菌剂保存30 d时活菌数大小为:泥炭 > 蚯蚓粪肥 > 花生壳粉 > 米糠 > 秸秆肥 > 鸡粪肥 > 猪粪肥;保存120 d时,以蚯蚓粪肥作为载体的djl-6菌剂活菌数最高。以D-2作为接种微生物的菌剂保存30 d时活菌数大小为:泥炭 > 鸡粪肥 > 花生壳粉 > 米糠 > 猪粪肥 > 蚯蚓粪肥 > 秸秆肥;保存120 d时,以猪粪肥作为载体的D-2菌剂活菌数最高。以两种菌株做接种微生物的菌剂中均以花生壳粉活菌数下降最快,这是因为过高的含水量以及持水能力过大导致其在保存30 d时出现了杂菌污染。
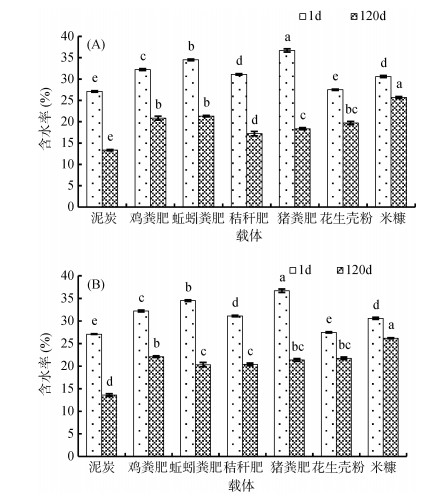
2.6 不同载体菌剂的含水率变化菌剂的含水率变化直接影响到接种微生物的存活,含水率过高和过低都不利于菌剂的保存。随着时间的延长,各菌剂含水率整体都有下降。各载体菌剂保存120 d后的含水率变化如图 5所示,以菌株djl-6和D-2作为接种微生物的菌剂中均以泥炭作为载体的菌剂含水率最低,分别为13.34% 和13.60%;以米糠作为载体的菌剂含水率最高,分别高达25.69% 和26.18%;以堆肥作为菌剂吸附载体的各个处理中,含水率均在20.00% 左右。
|
(djl-6;B. D-2;图中小写字母不同表示不同载体菌剂间含水率差异达P < 0.05显著水平) 图 5 不同载体菌剂含水率变化 |
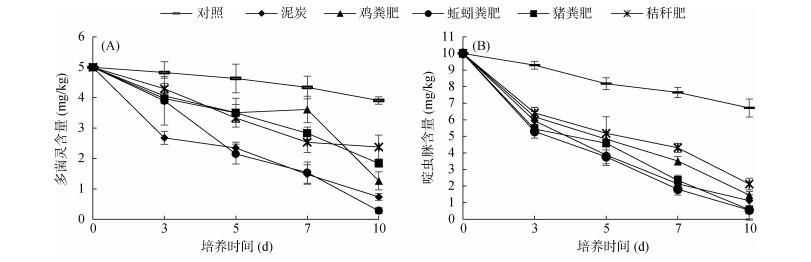
图 6为不同载体菌剂对土壤农药残留的降解。由图可见,与对照相比,以djl-6为接种微生物的各载体菌剂中多菌灵含量均有不同程度的下降;3 d时,以施加泥炭菌剂的处理中多菌灵降解最快,其余菌剂处理降解较慢;10 d时,各处理以施加蚯蚓粪菌剂的降解率最高,在第10天时的降解率可以达到94.30%,其降解效果优于泥炭以及其他堆肥载体。以D-2为接种微生物的各载体菌剂中啶虫脒含量均有不同程度的下降;3 d时,以施加蚯蚓粪菌剂的处理中啶虫脒降解最快;7 d时,各处理以施加蚯蚓粪菌剂的降解率最高,在第7天时的降解率可以达到81.87%,其降解效果优于泥炭以及其他堆肥载体;第10天时,各处理中啶虫脒含量与对照相比均显著下降,这可能与啶虫脒的自然降解有关。
|
(djl-6;B. D-2) 图 6 不同载体菌剂对土壤农药残留的降解 |
作为评价菌剂质量的一个重要指标,载体的吸水率直接影响着接种微生物的生长[21-23]。载体需要为吸附在其上面的微生物的生长提供湿润的生存环境才能使得微生物能够在较长的一段时间生存,这也就意味着可以延长菌剂的保存时间。而本研究中所使用的载体除了鸡粪肥之外,其余载体吸水率均处于60% 以上,能为接种微生物的生长提供充足的水分。微生物接种材料含水率过低不能供应微生物的日常生存需求,而含水率过高会导致载体菌剂在保存时期菌剂的质量发生变化,产生霉菌,危及接种菌株的生存。本文所研究的各个载体自然状态下风干3 d后的含水率在7.09% ~ 16.70%,满足制作菌剂的所需的载体含水率标准[24]。pH也是一个影响微生物在载体中生存的因素,pH为中性的条件下适合微生物在载体中的生长繁殖,当pH低于5时,微生物生长受到明显的抑制[25-26]。然而不同的细菌,其最适的生长pH也不相同。本研究所使用的两株农药降解菌其最适生长的pH范围为6 ~ 8,而本研究所使用的大多载体的pH也介于6 ~ 8,可以满足细菌生长的条件。对于不同载体养分情况的测定,发现猪粪肥、鸡粪肥等有机肥中氮磷等元素含量较高。后续研究发现以猪粪肥、鸡粪肥等有机肥作为载体时固体菌剂的有效菌数释放率与活菌数较高,这可能与降解菌株更好地利用氮磷等营养元素生长有关。
当前,人们对于固体菌剂质量评估的标准主要是以活菌数作为一个重要指标,却极少报道固体菌剂的有效菌数释放率,然而后者却是真正能够反映接种菌剂应用效果的一个指标。本研究表明,同种菌的有效菌数释放率随着不同的载体改变而变化,同种载体接种不同的微生物,其有效菌数释放率也不同,这与牛彦波等[27]的研究结果一致。载体的有效菌数释放率过低可能是因为外源接种的微生物对载体需要有一个不同时间的适应过程,也可能是因为载体中内部微孔结构中可利用的有效营养物质太少而导致微生物大量死亡。而本研究中以djl-6作为接种微生物的载体菌剂中,以蚯蚓粪有效菌数释放率最高,达到了100.40%,这是因为接种djl-6到蚯蚓粪后,djl-6在其中进行了大量的增殖。而以D-2作为接种微生物的载体菌剂中,也是以蚯蚓粪有效菌数释放率最高,达到了82.03%。
固体菌剂的活菌数是载体菌剂评价的主要指标[28]。本试验通过稀释涂布平板法计算各菌剂的活菌数,结果表明,各菌剂活菌数均随时间的延长而下降。固体菌剂最适保藏期在30 d内,而如若保存时间太长,也会出现污染。因此,有必要根据不同的载体进行不同的灭菌处理来提高菌剂活菌数。微生物的生长,除了要保证其所需的营养物质、矿质元素之外,还需要保证氧含量以及生长的湿度。本研究表明,各载体菌剂的含水率均随时间延长而下降,这可能是菌剂中活菌数下降的主要原因。但过高的含水率又会导致菌剂的污染,比如以花生壳粉作为吸附载体的固体菌剂在30 d左右外观开始变黑且出现杂菌。目前的研究中关于固体菌剂保存过程中含水率动态变化的研究极少,因此有必要通过调节固体菌剂在保存过程中的含水率来调控菌剂的活菌数。
不同的载体菌剂其降解农药的速度也并不相同,固体菌剂加入到土壤中后,其降解速度相对较慢,这是因为接种微生物从载体中释放到土壤中需要一个适应过程。两种菌剂均以蚯蚓粪作为载体的菌剂降解效果最好,其中以djl-6作为接种微生物的蚯蚓粪能够在10 d内降解土壤中90% 以上的浓度为5 mg/kg干土的多菌灵,以D-2作为接种微生物的蚯蚓粪能够在7 d内降解土壤中80% 以上的浓度为10 mg/kg干土的啶虫脒。
4 结论以蚯蚓粪肥作为载体时,菌株djl-6、D-2有效菌数释放率最高,分别达到了100.40% 和82.03%。以蚯蚓粪为载体的djl-6菌剂以及D-2菌剂在保存120 d时,活菌数均能维持在108 cfu/g。以蚯蚓粪为载体的djl-6菌剂以及D-2菌剂在保存30 d后仍能有效降解土壤中的多菌灵及啶虫脒农药残留。菌剂在保存30 d时,虽然以泥炭为载体的菌剂活菌数最高,但是泥炭作为一种不可再生资源,其价格偏高且再生速度慢,因此可将以蚯蚓粪为载体的菌剂进行大规模应用。
| [1] |
陈莎莎, 孙敏, 王文超, 等. 溶磷真菌固体发酵菌肥对玉米生长及根际细菌群落结构的影响[J]. 农业环境科学学报, 2018, 37(9): 1910-1917 (  0) 0) |
| [2] |
Fernandez A L, Sheaffer C C, Wyse D L, et al. Associations between soil bacterial community structure and nutrient cycling functions in long-term organic farm soils following cover crop and organic fertilizer amendment[J]. Science of the Total Environment, 2016, 566/567: 949-959 DOI:10.1016/j.scitotenv.2016.05.073 (  0) 0) |
| [3] |
文娅, 赵国柱, 周传斌, 等. 生态工程领域微生物菌剂研究进展[J]. 生态学报, 2011, 31(20): 6287-6294 (  0) 0) |
| [4] |
李刘刚, 吴晓芙, 冀泽华, 等. 粟米糠-耐Pb菌株复合吸附剂固定床穿透曲线特性[J]. 环境科学学报, 2017, 37(7): 2658-2666 (  0) 0) |
| [5] |
Cong P F, Ouyang Z, Hou R X, et al. Effects of application of microbial fertilizer on aggregation and aggregate-associated carbon in saline soils[J]. Soil and Tillage Research, 2017, 168: 33-41 DOI:10.1016/j.still.2016.12.005 (  0) 0) |
| [6] |
王文丽, 李娟, 赵旭. 生物有机肥对连作当归根际土壤细菌群落结构和根腐病的影响[J]. 应用生态学报, 2019, 30(8): 2813-2821 (  0) 0) |
| [7] |
赵旭, 王改兰, 陈春玉, 等. 谷糠和堆肥作为微生物菌剂载体的研究[J]. 安徽农业科学, 2015, 43(14): 179-180, 223 DOI:10.3969/j.issn.0517-6611.2015.14.069 (  0) 0) |
| [8] |
曾令涛, 王东升, 王祯祎, 等. 蚯蚓堆肥与益生菌配施对土壤肥力及微生物特性的影响[J]. 土壤, 2016, 48(6): 1100-1107 (  0) 0) |
| [9] |
张志红, 李华兴, 冯宏, 等. 堆肥作为微生物菌剂载体的研究[J]. 农业环境科学学报, 2010, 29(7): 1382-1387 (  0) 0) |
| [10] |
朱丹, 张磊, 韦泽秀, 等. 菌肥对青稞根际土壤理化性质以及微生物群落的影响[J]. 土壤学报, 2014, 51(3): 627-637 (  0) 0) |
| [11] |
宋以玲, 于建, 陈士更, 等. 复合微生物菌剂对棉花生理特性及根际土壤微生物和化学性质的影响[J]. 土壤, 2019, 51(3): 477-487 (  0) 0) |
| [12] |
肖蓉, 孙海峰, 聂园军, 等. 复合微生物菌剂对重茬苹果园土壤细菌群落的影响[J]. 微生物学通报, 2016, 43(2): 301-309 (  0) 0) |
| [13] |
许敬亮. 多菌灵降解菌的分离、鉴定及其降解特性研究[D]. 南京: 南京农业大学, 2006: 43-52.
(  0) 0) |
| [14] |
杨洪杏. 啶虫脒降解菌株的分离、降解关键酶基因克隆及啶虫脒污染土壤生物修复研究[D]. 南京: 南京农业大学, 2016: 20-26.
(  0) 0) |
| [15] |
勾芒芒, 屈忠义. 生物炭与化肥互作对土壤含水率与番茄产量的影响[J]. 农业机械学报, 2018, 49(11): 283-288 DOI:10.6041/j.issn.1000-1298.2018.11.033 (  0) 0) |
| [16] |
吴淑娟, 任运涛, 吴彩霞, 等. 草地土壤pH值测定方法比较研究[J]. 土壤通报, 2018, 49(2): 343-348 (  0) 0) |
| [17] |
叶红玲, 刘冬, 任文涛. 半微量凯氏定氮法快速测定复混肥料中总氮含量的研究[J]. 安徽农业科学, 2015, 43(31): 28-29 DOI:10.3969/j.issn.0517-6611.2015.31.011 (  0) 0) |
| [18] |
张艳艳. 复合肥料中的氮、磷、钾含量测定要点[J]. 中国新技术新产品, 2018(7): 50-51 DOI:10.3969/j.issn.1673-9957.2018.07.032 (  0) 0) |
| [19] |
Morais F A, Gatiboni L C. Phosphorus availability and microbial immobilization in a Nitisol with the application of mineral and organo-mineral fertilizers[J]. Anais Da Academia Brasileira De Ciências, 2015, 87(4): 2289-2299 DOI:10.1590/0001-3765201520140008 (  0) 0) |
| [20] |
Ansari R A, Mahmood I. Optimization of organic and bio-organic fertilizers on soil properties and growth of pigeon pea[J]. Scientia Horticulturae, 2017, 226: 1-9 DOI:10.1016/j.scienta.2017.07.033 (  0) 0) |
| [21] |
Feng F Y, Ge J, Li Y S, et al. Isolation, colonization, and chlorpyrifos degradation mediation of the endophytic bacterium Sphingomonas strain HJY in Chinese chives (Allium tuberosum)[J]. Journal of Agricultural and Food Chemistry, 2017, 65(6): 1131-1138 DOI:10.1021/acs.jafc.6b05283 (  0) 0) |
| [22] |
雷先德, 李金文, 徐秀玲, 等. 微生物菌剂对菠菜生长特性及土壤微生物多样性的影响[J]. 中国生态农业学报, 2012, 20(4): 488-494 (  0) 0) |
| [23] |
Chen Y K, Jiang Z, Wu D, et al. Development of a novel bio-organic fertilizer for the removal of atrazine in soil[J]. Journal of Environmental Management, 2019, 233: 553-560 DOI:10.1016/j.jenvman.2018.12.086 (  0) 0) |
| [24] |
刘雯雯, 姚拓, 孙丽娜, 等. 菌糠作为微生物肥料载体的研究[J]. 农业环境科学学报, 2008, 27(2): 787-791 DOI:10.3321/j.issn:1672-2043.2008.02.071 (  0) 0) |
| [25] |
韩华雯. 几种新型植物根际促生菌肥载体筛选及研究[D]. 兰州: 甘肃农业大学, 2013: 13-19.
(  0) 0) |
| [26] |
Bargaz A, Lyamlouli K, Chtouki M, et al. Soil microbial resources for improving fertilizers efficiency in an integrated plant nutrient management system[J]. Frontiers in Microbiology, 2018, 9: 1606 DOI:10.3389/fmicb.2018.01606 (  0) 0) |
| [27] |
牛彦波, 吴皓琼, 李智. 载体、灭菌方式及pH对生物肥料产品活菌数及保存期的影响[J]. 黑龙江八一农垦大学学报, 2003, 15(3): 36-39 DOI:10.3969/j.issn.1002-2090.2003.03.010 (  0) 0) |
| [28] |
陈慧君. 微生物肥料菌种应用与效果分析[D]. 北京: 中国农业科学院, 2013: 20-27.
(  0) 0) |
 2021, Vol. 53
2021, Vol. 53


