2. 中国科学院大学, 北京 100049
哈密瓜是主要的设施大棚作物之一,我国的种植面积和产量居世界之首[1]。但由于国内大棚栽培管理中存在很多误区,对种植中出现的土传病害尚无有效防治措施,导致了巨大经济损失。在哈密瓜设施大棚种植中,连作是产生土传病害的主要原因,而根际微生物区系失衡是连作障碍发生的重要原因[2]。长期连作条件下,作物根系分泌物会持续诱导病原菌在根系的定殖和侵染,从而造成病害的发生[3]。哈密瓜的土传病害主要有枯萎病、蔓枯病、根腐病等[4],是由土壤中的尖孢镰刀菌(Fusarium oxysporum)、蔓枯病菌(Didymella bryoniae)等侵染所致[5],其使植物组织受到损伤,对作物生长产生非常不利的影响,极大地降低哈密瓜产量和质量,严重时甚至直接导致作物死亡,造成绝收现象。
目前针对土传病害问题,主要通过种植管理和土壤消毒两种方式进行防控。种植管理通过抗病品种选育、种苗消毒、嫁接以及农药等措施来降低病害,但并未从根本上解决植物病害的发生;土壤消毒则以消灭病原物的方式对病害进行防控,主要利用氯化苦、棉隆等化学药剂在作物种植前对土壤进行熏蒸处理。熏蒸技术高效快捷,得到广泛的运用,但高毒性的熏蒸剂,如氯化苦,往往存在着不容忽视的环境问题。棉隆虽然属于低毒类消毒材料,但有研究表明其在土壤中的分解产物会对环境中生物产生一定毒性,在使用时存在一定的环境安全风险[6]。另外,也有人认为化学熏蒸剂的使用不利于土壤中有益微生物的群落构建,从长远来看可能会加剧土壤病害[7]。
油菜籽粕本身作为一种天然绿色有机物,能为土壤肥力作出贡献,促进土壤碳、氮代谢的调节[8],重要的是其有作为土壤熏蒸剂的潜力来防治土壤病虫害,很多研究表明籽粕在促进作物生长和抑制病原菌方面都具有显著效果[9-10]。籽粕的熏蒸潜力来源于其富含的硫代葡萄糖苷,此类物质水解可产生有广泛杀菌性的次级产物[11],因此当籽粕作为熏蒸材料加入土壤后,会抑制土壤中病原菌的生命活动,从而影响微生物的群落组成。有研究者对籽粕熏蒸处理后的土壤进行微生物组成分析,发现籽粕的加入显著降低了胡椒枯萎病菌的相对丰度,从而抑制了病害的发生[12]。此外,与传统化学熏蒸剂相比,除了绿色无害,籽粕还能更持久地抑制土壤中某些有害生物,从而更长效地对病害起到防控效果[7]。
为探究籽粕用于哈密瓜土传病害防治的效果以及对土壤中真核微生物群落的影响,本研究利用十字花科籽粕和传统化学熏蒸剂棉隆作为熏蒸材料,对土壤中真核微生物的动态变化过程作了探讨,分析了籽粕与棉隆对土壤微生物的影响,并结合真核微生物群落与作物发病情况,评估了其相互间的关系,以为籽粕用于哈密瓜病害防治技术的研究提供理论基础。
1 材料与方法 1.1 试验材料试验地位于安徽省亳州市谯城区哈密瓜种植基地(33°45′N,115°40′E),该基地大棚内常年连作哈密瓜,多种土传病害相伴发生,作物病害严重。
用于试验地熏蒸的籽粕,由油菜籽压榨油料后的残渣经粉碎过筛(2 mm)得到,分为白菜型(Brassica campes)和芥菜型(Brassica juncea)两种类型,分别购于甘肃省天水市和新疆阿克苏地区。用作阳性对照使用的化学熏蒸农药棉隆(Dazomet,纯度98%)购于武汉远成共创科技有限公司,有广谱的杀菌和杀虫作用。
1.2 试验方法试验开始于2019年7月中旬,同年10月底结束。在哈密瓜种植前翻耕土壤,深度15 cm左右,尽可能碎土以增加土壤孔隙度。翻耕后用水浇透供后续熏蒸材料更好地发挥功效,待土壤相对湿度为50% ~ 70%,加入熏蒸材料,白菜型和芥菜型籽粕的用量均为2.2 kg/m2,棉隆根据当地使用经验以40 g/m2的用量添加。加料后通过翻耕机将料物均匀混入土壤中,并立刻用塑料薄膜覆盖试验地,四边用土压实提供密闭的熏蒸环境。处理2周后揭膜散气,后续哈密瓜种植按当地常规管理进行。试验共设置4个处理,分别为对照(CK)、白菜型籽粕(B)、芥菜型籽粕(J)和棉隆(ML),每个处理设置4个小区,每个小区长6.5 m、宽5.5 m。在整个土壤处理和后期种植过程中,对土壤共进行4次取样,分别为熏蒸处理前(T1)的混合土壤,熏蒸处理后(T2)的小区土壤,苗期(T3)的小区土壤以及成熟期(T4)的根际土壤。并在成熟期(T4)时随机取样统计各小区单果重量,同时统计各处理小区内所有植株的病株率从而计算防效,计算方式如下:病株率(%)=病株数/总株数×100,防效(%)= (对照病株率-处理病株率)/ 对照病株率×100[13]。
1.3 真核微生物群落组成测定DNA提取:采用MP Biomedicals公司的FastDNA Spin Kit for Soil土壤DNA提取试剂盒提取土壤微生物总DNA,供后续微生物18S rRNA基因的测序。
测序及分析:DNA样品经检测、PCR扩增、纯化、建库后在NovaSeq平台对样品18S rDNA的V4区域(528F ~ 706R)进行测序;测序后的下机数据进行拼接、质控和过滤,得到用于后续分析的有效数据;对有效数据以97% 的一致性进行OTUs(operational taxonomic units)聚类,然后对OTUs的序列进行物种注释,得到对应的物种信息和基于物种的丰度分布情况。
1.4 数据处理使用OTUs序列数据基于加权Bray-Curtis距离进行UPGMA聚类和PCoA主坐标分析,评估不同处理下的微生物群落结构;并通过ANOSIM相似分析检验各处理间的群落结构差异;通过FunGuild对根际微生物进行功能预测;基于t检验检测主要微生物的丰度差异,并通过Pearson相关性分析评估主要微生物与哈密瓜发病率间的相关性。分析和绘图采用SPSS 21.0、R 3.5.3和Origin 9.0软件。
2 结果与分析 2.1 籽粕处理后哈密瓜的生长和发病情况哈密瓜的生长和发病统计结果显示,籽粕的加入能够显著降低哈密瓜病株率并增加其产量,而棉隆处理仅对防效有帮助,对增产作用并不显著(表 1)。与对照组51.13% 的病株率相比,经白菜型、芥菜型籽粕和棉隆熏蒸处理的哈密瓜病株率均显著降低,分别仅有25.94%、23.18% 和22.74%,防效达到了49.26%、54.66% 和55.53%。在作物生长方面,籽粕的加入促进了哈密瓜的生长,白菜型和芥菜型籽粕处理后的哈密瓜单果重较对照组分别提高了18.66%和10.04%,而棉隆处理对果实质量的增加并不显著(P > 0.05,表 1),说明相较于棉隆,籽粕作为熏蒸剂对哈密瓜的生长有更好的促进作用。
|
|
表 1 不同处理哈密瓜的生长和发病情况 Table 1 Growth and incidence of cantaloupe under different treatments |
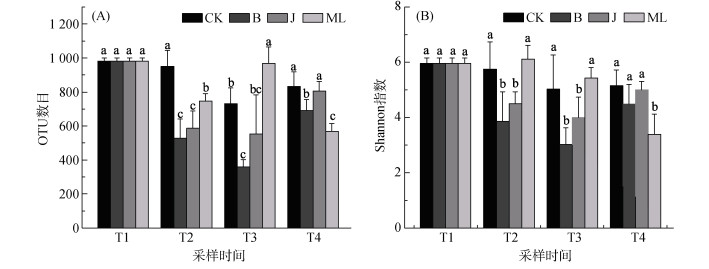
加入籽粕在前期较棉隆更大程度地降低了土壤中真核微生物的丰富度和多样性,且在后期有更加明显的恢复趋势(图 1)。白菜、芥菜型籽粕熏蒸处理后土壤(T2)中的物种丰富度和多样性结果相似(图 1,P > 0.05),物种数目和Shannon指数分别为529、586和3.9、4.5,但均显著低于对照组(图 1,P < 0.05);苗期(T3)土壤中微生物多样性结果变化不大,但在成熟期(T4)的根际土壤中,籽粕处理下的微生物丰富度和多样性得到了恢复,白菜、芥菜型籽粕处理下的物种数目分别上升到691、805,与对照组的差异较前期明显减小,Shannon指数也分别上升到了4.48和5.01,与对照组间无显著性差异(图 1,P > 0.05)。棉隆处理对前期(T2、T3)土壤中微生物的多样性无显著影响,但显著影响了物种丰富度;而在成熟期(T4)根际土壤中,棉隆处理对微生物的物种丰富度和多样性均有显著影响,物种数目和Shannon指数分别仅有569和3.38,显著低于对照组和籽粕处理组(图 1,P < 0.05)。
|
(图中不同小写字母代表同一时期处理间差异显著(P < 0.05)) 图 1 各处理下微生物物种丰富度(A)和多样性(B) Fig. 1 Richness (A) and diversities (B) of microbial community under different treatments |
群落多样性的结果说明,籽粕和棉隆处理对土壤中微生物的改变方式和过程存在差异,籽粕处理会影响土壤中微生物的丰富度及多样性,而棉隆处理的影响仅体现在丰富度上,且籽粕处理相较于棉隆处理,存在微生物群落的恢复过程,不会显著降低根际微生物的丰富度和多样性。
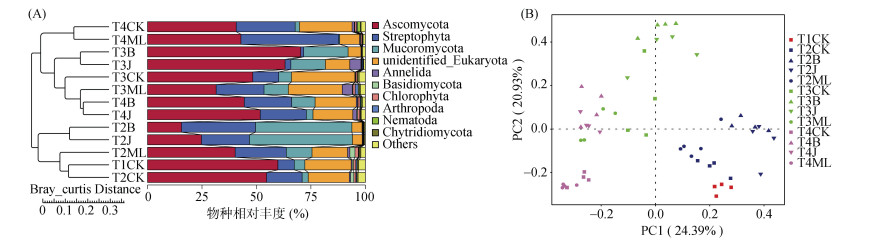
2.3 籽粕对土壤微生物群落结构的影响基于Bray-Curtis距离算法,使用UPGMA聚类和PCoA主坐标分析方法评估籽粕和棉隆处理在时间尺度上对土壤和根际真核微生物群落结构的扰动,分析时间和不同熏蒸处理对群落结构的影响。结果表明,在UPGMA聚类树和PCoA主坐标图中,同一时间点的处理间距离更近,相似度更高,按照哈密瓜生育期主要可划分为哈密瓜作物种植前(T1,熏蒸处理前;T2,熏蒸处理后)和种植后(T3,苗期;T4,成熟期)两大分支(图 2),说明微生物群落结构在时间尺度上的区分更为明显。进一步分析不同熏蒸处理对微生物群落结构的影响,发现籽粕处理相对于棉隆处理,能更显著地改变土壤中微生物群落。ANOSIM相似性分析表明,除了T3时期的芥菜籽粕处理,两种籽粕处理在熏蒸后(T2)和种植期(T3、T4)均能明显影响微生物群落结构,与对照组间存在显著差异(表 2,P < 0.05),而棉隆处理的群落结构仅在苗期(T3)与对照组间有显著差异(表 2)。
|
图 2 T1 ~ T4时期不同处理下的微生物UPGMA聚类分析(A)和PCoA主坐标分析(B) Fig. 2 UPGMA cluster (A) and PCoA (B) analyses of microbial community under different treatments from T1 to T4 periods |
|
|
表 2 相似性分析(ANOSIM)评估籽粕和棉隆处理在T2 ~ T4时期对微生物群落结构的影响 Table 2 Analysis of similarities (ANOSIM) to assess effects of seed meals and dazomet on microbial community compisition from T2 to T4 periods |
微生物群落结构的差异结果说明,籽粕与棉隆处理对微生物的扰动是存在显著差异的,白菜和芥菜型籽粕能更显著地引起土著真核微生物群落的改变,并且这种改变是持续在整个生产过程中的。
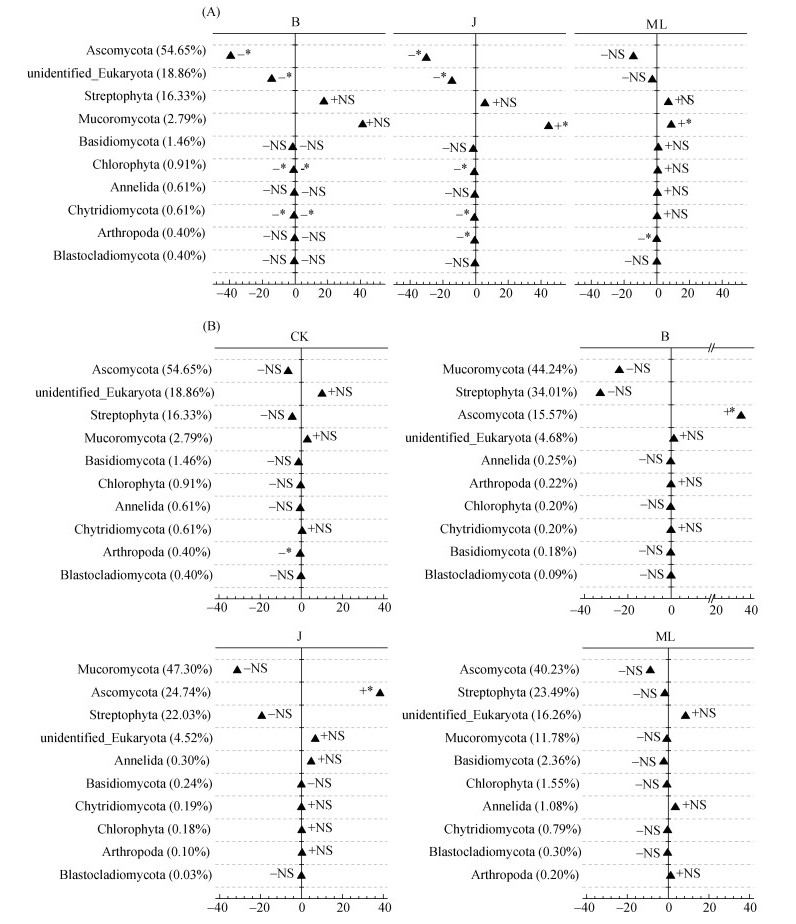
2.4 籽粕对土壤微生物群落动态变化和根际微生物富集的影响籽粕和棉隆处理均能引起土壤中真核微生物群落的变化,但其在微生物削减、微生物恢复和最终的根际微生物定殖方面都有显著不同。在白菜和芥菜籽粕熏蒸处理后(T2),土壤中的主要门水平真核微生物较对照发生了显著的丰度变化,而棉隆处理下的主要微生物基本没有呈现明显的丰度变化。土壤中最主要的微生物群子囊菌门(Ascomycota)相对丰度高达54.65%,在白菜和芥菜籽粕处理后显著减少到15.57% 和24.74%,下降了39.08% 和29.91%;另一个未定义的门(unidentified_Eukaryota)作为主要微生物群,其相对丰度达到18.86%,在白菜和芥菜籽粕处理下相对丰度也显著下降了14.19% 和14.37%;而被孢霉门(Mucoromycota)在白菜和芥菜籽粕处理后相对丰度得到大幅提升,在2.79% 的基础上分别提高了41.45%和44.50%;此外,在棉隆处理中,主要微生物群中仅被孢霉门相对丰度显著提升了9.00%,其他主要门水平微生物与对照组间无显著性差异(图 3A)。
|
(横坐标为相对丰度差异值(%);“+”代表相对丰度在比较组中高于被比较组,“–”代表低于被比较组;“*”代表差异具有显著性(P < 0.05),“NS”代表差异无显著性(P > 0.05)) 图 3 T2时期各处理与对照组间(A)及各处理在T2与T3时期间(B)门水平上物种相对丰度的差异分析 Fig. 3 Differences in relative abundance at phylum level under different treatments compare to CK at T2 period(A) and under different treatments between T2 and T3 periods(B) |
熏蒸处理后(T2)到苗期(T3)的这一阶段,对照和棉隆处理中主要门水平微生物基本无显著变化,但白菜和芥菜籽粕处理下的微生物发生了显著变化(图 3B)。较熏蒸处理后(T2),苗期(T3)时的白菜和芥菜籽粕处理中的子囊菌门(Ascomycota)相对丰度得到了恢复和显著提升,分别增加了54.78% 和38.40%;而毛霉菌门(Mucoromycota)和链形植物门(Streptophyta)的相对丰度在T2和T3时的差异虽不显著,但呈现了降低的变化趋势(图 3B)。
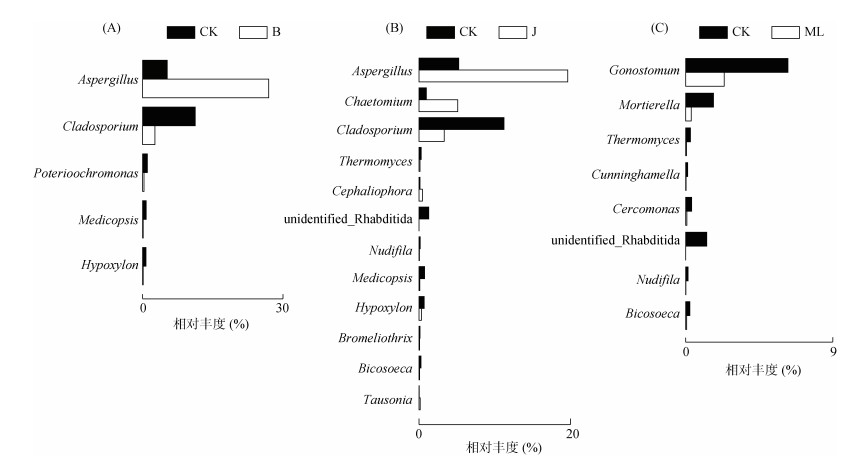
在哈密瓜成熟期(T4)的根际土壤中,通过FUNGuild功能预测对主要微生功能群进行分析,在结果中出现3个潜在的植物病原菌群,且这3种功能菌群在白菜和芥菜籽粕处理下的含量要明显低于对照和棉隆处理(图 4),说明这两种籽粕处理都有效地抑制了根际相关病原菌的定殖,有利于根际微生物群落的构建。为探究不同熏蒸处理对根际微生物群落构建的影响,在属水平上比较了各熏蒸处理与对照组间的主要微生物丰度差异(图 5)。结果发现,主要有以下属在熏蒸处理和对照间具有显著性差异:曲霉菌属(Aspergillus)、枝孢属(Cladosporium)、毛壳菌属(Chaetomium)、殖口虫属(Gonostomum)和被孢霉菌属(Mortierella)。其中曲霉菌属在白菜和芥菜籽粕处理中的相对丰度高达26.97% 和19.68%,显著高于对照组的5.25%;毛壳菌属的差异仅出现在芥菜籽粕处理与对照组间,相较于对照组中相对含量仅有0.96%,其在芥菜籽粕中的相对丰度上升到了5.13%。这两个属在对病害的防治中起到了重要的作用,在相关性分析中呈现出了与疾病间显著的相关性(表 3)。曲霉菌属与发病率间呈显著的负相关关系(r = -0.526,P = 0.036),且通过更近一步的物种分析可发现,曲霉菌属下的主要种慢性曲霉(Aspergillus lentulus)与发病率间也呈显著负相关关系(r = -0.505,P = 0.046);而毛壳菌属虽然于发病率间没有显著相关性,但其下种OTU_213与发病率间呈现了显著的负相关关系。说明慢性曲霉菌和毛壳菌属下种OTU_213也许能对哈密瓜病害的防治起到关键作用,属于根际的抗病有益菌。

|
图 4 FunGuild根际微生物群生态功能预测 Fig. 4 FunGuild ecological function prediction of rhizosphere microbiota |
|
图 5 T4时期对照与白菜籽粕(A)、芥菜籽粕(B)和棉隆(C)处理间在属水平上物种相对丰度的差异分析 Fig. 5 Differences in relative abundances at genus level between CK and treatments of Brassica campes seed meal (A), B. juncea seed meal (B), and dazomet (C) at T4 period |
|
|
表 3 关键物种与发病率的Pearson相关性分析 Table 3 Pearson correlation coefficients of key species and incidence rate |
对土壤进行籽粕熏蒸处理后,土壤中某些微生物的生长因其水解产物的毒性作用受到抑制,整体上呈现出丰富度和多样性显著下降的趋势,但这种趋势在作物成熟时消失,微生物多样性恢复到与对照组同一水平(图 1)。这一结论与前人的籽粕防病研究结论相似,籽粕处理下真菌群落微生物与对照间的差异度在作物种植后显著减小[14]。与棉隆处理对土壤丰富度和多样性单一的削减不同,籽粕处理对土壤中微生物的变化影响更为复杂,会经历生物削减和恢复两个过程。
虽然籽粕广谱的灭生性使微生物多样性整体下降,但其能抑制作物根际病原菌的定殖并促进独特微生物的富集,构建特异的微生物群落结构[6],而这种微生物群落可能在一定程度上也会产生挥发性有机物质,使病原真菌细胞膜或抗氧化系统功能异常[15],起到进一步的熏蒸抑病效果。尽管在本试验中并未发现哈密瓜主要致病菌(腐霉属(Pythium)和镰刀属(Fusarium)真菌)在处理间的显著差异,但FunGuild分析结果表明(图 4),籽粕处理确实对一些潜在植物病原菌存在综合抑制作用,使得根际微生物的病原菌数量减少,从而达到抑病效果。油菜籽粕对土壤中多种病原菌有抑制效果[16-17],而土壤中的籽粕养分含量会驱动微生物群落结构的转变[18],促进一些有益微生物的富集。在籽粕作用下,一类关键真核微生物子囊菌门(Ascomycota)经历了显著的变化,影响了微生物群落的构建,该门经过籽粕熏蒸作用后相对丰度先是显著降低(图 3A),然后在后续作物种植过程中又迅速恢复和扩繁,重新占据了土壤环境中的主要生态位(图 3B)。而在哈密瓜生长后期,子囊菌门中的一些特定物种也作为有益微生物参与了根际微生物的构建,与病害间呈现出显著的负相关关系(表 3)。由于籽粕中特有的高碳氮含量会促进腐生真菌的繁殖[19],使得子囊菌门下的曲霉菌属(Aspergillus)相对丰度得到提升,出现可能可以抑制病原菌的有益微生物。有研究利用曲霉菌属下的Aspergillus flavus、Aspergillus niger和Aspergillus terreus实现了对哈密瓜病原菌F. oxysporum f. sp.melonis的抑制[20]。在本研究中,发现曲霉菌属下慢性曲霉(Aspergillus lentulus)与哈密瓜发病率间呈显著负相关性(表 3),可能是作为有益菌存在于根际中,对有害微生物起到了拮抗作用,从而抑制了相关功能病原菌群在根际的定殖(图 4)。同样可能与抑病有关的还有芥菜型籽粕处理下富集的毛壳菌属(Chaetomium),该属下的一些微生物对病原性镰刀菌(Fusarium)具有拮抗作用[21-22],通过深入分析也发现,本研究中毛壳菌属下的一个未知种(OTU_213)与哈密瓜发病率间具有显著的负相关关系(表 3),可能也属于一类有益菌定殖于根际发挥抗病作用。
在白菜和芥菜籽粕的生物熏蒸过程中,灭生作用以及慢性曲霉和毛壳菌属下物种OTU_213的富集可能共同促进了根际微生物中病原功能菌的减少,从而降低了作物的发病率。但两种籽粕在土壤中水解次级产物和养分含量的不同,可能造成了它们具体抑菌效果和群落结构的差异[11]。而相较于不同籽粕类型间的差异,不同熏蒸材料棉隆与籽粕处理间的差异更为明显,且单一成分的化学熏蒸剂棉隆在根际对病原菌的抑制和有益微生物的富集方面均不如籽粕,对整体微生物群落结构的改变主要集中在前期熏蒸的环节,在后期微生物群落的恢复以及有益微生物群落的构建方面并没有起到明显的帮助作用,因此棉隆的化学熏蒸抑病效果可能没有籽粕持久,不能像籽粕一样形成生物屏障抑制土壤病原菌的定殖和二次侵染[23]。此外,棉隆广谱的杀菌性会降低非靶向微生物活性和数量,并不利于改善土壤生产力[24-25],也不利于农业生态的可持续发展。
4 结论白菜型和芥菜型籽粕处理土壤能够对哈密瓜土传病害起到显著的防治作用,虽然防治效果与棉隆处理相似,但在对微生物群落动态变化的影响上有明显差异,且在后期根际微生物富集方面,两种籽粕处理减少植物病原菌群定殖的同时产生了可抑制病原菌的有益微生物。整体上,两种籽粕通过对特定土著微生物的灭杀、恢复和富集过程,实现了对根际有益微生物的筛选,起到了对哈密瓜病害的防控作用,是一种较传统熏蒸剂更为绿色科学的病害防控材料。
| [1] |
王虹, 周晓静, 李金玲, 等. 甜瓜枯萎病及其综合防治[J]. 农业科技通讯, 2019(5): 313-315 DOI:10.3969/j.issn.1000-6400.2019.05.122 (  0) 0) |
| [2] |
姚小东, 李孝刚, 丁昌峰, 等. 连作和轮作模式下花生土壤微生物群落不同微域分布特征[J]. 土壤学报, 2019, 56(4): 975-985 (  0) 0) |
| [3] |
杨珍, 戴传超, 王兴祥, 等. 作物土传真菌病害发生的根际微生物机制研究进展[J]. 土壤学报, 2019, 56(1): 12-22 (  0) 0) |
| [4] |
张猛, 李淼. 温室甜瓜土传病害防治技术[J]. 吉林农业, 2014(12): 81 DOI:10.3969/j.issn.1674-0432.2014.12.145 (  0) 0) |
| [5] |
哈矿武. 甜瓜主要病原菌的鉴定与抗病基因的分子定位[D]. 银川: 宁夏大学, 2008.
(  0) 0) |
| [6] |
陈丽萍, 赵学平, 吴长兴, 等. 棉隆对环境生物的急性毒性和安全性评价[C]//中国植物保护学会2009年学术年会论文集北京: 中国农业科学技术出版社, 2009: 696-700
(  0) 0) |
| [7] |
Mazzola M, Hewavitharana S S, Strauss S L. Brassica seed meal soil amendments transform the rhizosphere microbiome and improve apple production through resistance to pathogen reinfestation[J]. Phytopathology, 2015, 105(4): 460-469 DOI:10.1094/PHYTO-09-14-0247-R (  0) 0) |
| [8] |
李亮, 张佩佳, 张翔, 等. 不同饼肥配比对烟田土壤生物学特性及氮素转化的影响[J]. 土壤, 2019, 51(4): 648-657 (  0) 0) |
| [9] |
Chung W C, Huang J W, Huang H C, et al. Effect of ground Brassica seed meal on control of Rhizoctonia damping-off of cabbage[J]. Canadian Journal of Plant Pathology, 2002, 24(2): 211-218 DOI:10.1080/07060660309506998 (  0) 0) |
| [10] |
Mazzola M, Agostini A, Cohen M F. Incorporation of Brassica seed meal soil amendment and wheat cultivation for control of Macrophomina phaseolina in strawberry[J]. European Journal of Plant Pathology, 2017, 149(1): 57-71 DOI:10.1007/s10658-017-1166-0 (  0) 0) |
| [11] |
Sotelo T, Lema M, Soengas P, et al. In vitro activity of glucosinolates and their degradation products against brassica-pathogenic bacteria and fungi[J]. Appl Environ Microbiol, 2015, 81(1): 432-440 DOI:10.1128/AEM.03142-14 (  0) 0) |
| [12] |
Ren G, Ma Y, Guo D, et al. Soil bacterial community was changed after brassicaceous seed meal application for suppression of Fusarium wilt on pepper[J]. Frontiers in Microbiology, 2018, 9: 185 DOI:10.3389/fmicb.2018.00185 (  0) 0) |
| [13] |
顾卫中, 尤春, 韦运和. 西瓜白粉病和枯萎病药剂防治效果比较试验[J]. 农业科技通讯, 2014(4): 126-127 (  0) 0) |
| [14] |
Ma Y, Gentry T, Hu P, et al. Impact of brassicaceous seed meals on the composition of the soil fungal community and the incidence of Fusarium wilt on chili pepper[J]. Applied Soil Ecology, 2015, 90: 41-48 DOI:10.1016/j.apsoil.2015.01.016 (  0) 0) |
| [15] |
de Boer W, Li X G, Meisner A, et al. Pathogen suppression by microbial volatile organic compounds in soils[J]. FEMS Microbiology Ecology, 2019, 95(8): fiz105 DOI:10.1093/femsec/fiz105 (  0) 0) |
| [16] |
Mazzola M, Granatstein D M, Elfving D C, et al. Suppression of specific apple root pathogens by brassica napus seed meal amendment regardless of glucosinolate content[J]. Phytopathology, 2001, 91(7): 673-679 DOI:10.1094/PHYTO.2001.91.7.673 (  0) 0) |
| [17] |
Angus J F, Gardner P A, Kirkegaard J A, et al. Biofumigation: Isothiocyanates released frombrassica roots inhibit growth of the take-all fungus[J]. Plant and Soil, 1994, 162(1): 107-112 DOI:10.1007/BF01416095 (  0) 0) |
| [18] |
O'Donnell A G, Seasman M, MacRae A, et al. Plants and fertilisers as drivers of change in microbial community structure and function in soils[J]. Plant and Soil, 2001, 232(1/2): 135-145 DOI:10.1023/A:1010394221729 (  0) 0) |
| [19] |
Hollister E B, Hu P, Wang A S, et al. Differential impacts of brassicaceous and nonbrassicaceous oilseed meals on soil bacterial and fungal communities[J]. FEMS Microbiology Ecology, 2013, 83(3): 632-641 DOI:10.1111/1574-6941.12020 (  0) 0) |
| [20] |
Boughalleb-M'hamdi N, Salem I B, M'Hamdi M. Evaluation of the efficiency of Trichoderma, Penicillium, and Aspergillus species as biological control agents against four soil-borne fungi of melon and watermelon[J]. Egyptian Journal of Biological Pest Control, 2018, 28(1): 1-12 DOI:10.1186/s41938-017-0002-3 (  0) 0) |
| [21] |
Tomilova O G, Shternshis M V. The effect of a preparation from Chaetomium fungi on the growth of phytopathogenic fungi[J]. Applied Biochemistry and Microbiology, 2006, 42(1): 67-71 DOI:10.1134/S0003683806010108 (  0) 0) |
| [22] |
Tveit M, Wood R K S. The control of fusarium blight in oat seedlings with antagonistic species of chaetomium[J]. Annals of Applied Biology, 1955, 43(4): 538-552 DOI:10.1111/j.1744-7348.1955.tb02503.x (  0) 0) |
| [23] |
Motisi N, Doré T, Lucas P, et al. Dealing with the variability in biofumigation efficacy through an epidemiological framework[J]. Soil Biology and Biochemistry, 2010, 42(12): 2044-2057 DOI:10.1016/j.soilbio.2010.08.016 (  0) 0) |
| [24] |
曹云, 宋修超, 郭德杰, 等. 棉隆熏蒸与微生物有机肥联用对西瓜枯萎病的防控研究[J]. 土壤, 2018, 50(1): 93-100 (  0) 0) |
| [25] |
Klose S, Ajwa H A. Enzyme activities in agricultural soils fumigated with methyl bromide alternatives[J]. Soil Biology and Biochemistry, 2004, 36(10): 1625-1635 DOI:10.1016/j.soilbio.2004.07.009 (  0) 0) |
2. University of Chinese Academy of Sciences, Beijing 100049, China
 2021, Vol. 53
2021, Vol. 53


